
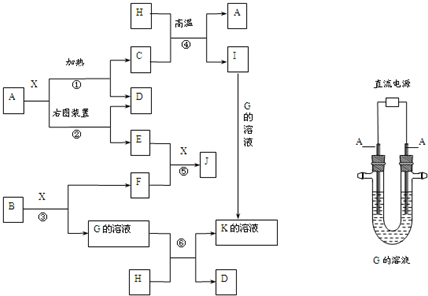
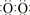 ]2-Na+
]2-Na+分析 X常温下为无色液体,可确定为H2O,B为淡黄色固体,且可与水反应生成气体单质,且B为Na2O2,G为氢氧化钠溶液,F为O2;A既能与水在高温下反应生成单质D,又可做电极电解氢氧化钠溶液得到D,且E在氧气和水的作用下得到J,J溶于酸为黄色溶液,则A为Fe,C为Fe3O4,D为H2,E为Fe(OH)2,J为Fe(OH)3;H既能与氢氧化钠溶液反应,又能与Fe3O4反应,故为金属Al,由此可知I 为Al2O3,K为NaAlO2,结合对应物质的性质以及题目要求可解答该题.
解答 解:X常温下为无色液体,可确定为H2O,B为淡黄色固体,且可与水反应生成气体单质,且B为Na2O2,G为氢氧化钠溶液,F为O2;A既能与水在高温下反应生成单质D,又可做电极电解氢氧化钠溶液得到D,且E在氧气和水的作用下得到J,J溶于酸为黄色溶液,则A为Fe,C为Fe3O4,D为H2,E为Fe(OH)2,J为Fe(OH)3;H既能与氢氧化钠溶液反应,又能与Fe3O4反应,故为金属Al,由此可知I 为Al2O3,K为NaAlO2,
(1)B为过氧化钠为离子化合物,电子式为Na+[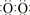 ]2-Na+;故答案为:Na+[
]2-Na+;故答案为:Na+[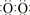 ]2-Na+;
]2-Na+;
(2)E为Fe(OH)2,用电解法制备时,阳极铁被氧化生成亚铁离子,G为氢氧化钠溶液,可生成Fe(OH)2,电极方程式为Fe+2OH--2e-=Fe(OH)2,Fe(OH)2不稳定,可被氧化生成Fe(OH)3,现象是白色物质迅速转变为灰绿色最终变为红褐色,
故答案为:Fe+2OH--2e-=Fe(OH)2;白色物质迅速转变为灰绿色最终变为红褐色;
(3)反应①是铁和水蒸气在高温下的反应生成四氧化三铁和氢气,反应的化学反应方程式是3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,反应④为铝热反应,可加少量KClO3,插上镁条并将其点燃,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;加少量KClO3,插上镁条并将其点燃;
(4)反应⑥是铝和氢氧化钠容易的反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2 H2O=2AlO2-+3H2↑;
(5)用题中的电解装置最终得到2molFe(OH)3沉淀,涉及反应有Fe+2H2O=Fe(OH)2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3,关系式为4Fe~10H2O,
则得到2molFe(OH)3沉淀消耗5mol水,
故答案为:5.
点评 本题考查了物质转化关系以及物质性质的综合应用,侧重于学生的分析能力的考查,为高考常见题型,主要是考查铁及其化合物的性质判断和应用,铝及其化合物的性质应用,物质的性质和反应现象,铝热反应,电解原理是解题关键,题目较难,需要熟练掌握物质性质、反应的现象和转化关系.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
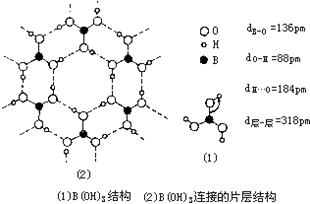 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.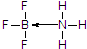 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在Zn-Cu原电池中加入双氧水后,灯泡亮度增加且持续时间较长 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3 min并过滤,滤液中可以加入适量的H2O2来氧化I? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.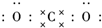 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com