
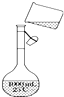
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)分析 (1)称量的粗盐固体要先溶解,才能再除杂,所以操作A是溶解,实现固体和液体的分离采用过滤;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;
(3)Mg(OH)2、CaCO3、BaCO3均会和盐酸反应;
(4)转移液体时,要用玻璃棒来引流.
解答 解:(1)称量的粗盐固体要先溶解,才能再除杂,固体和液体的分离采用过滤的方法,所以第⑤步中,操作B是过滤,故答案为:溶解;过滤;
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,
故答案为:除去离子钙离子及过量的钡离子;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:操作③④中生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制得精盐的纯度;
(4)向容量瓶中转移液体时,要用玻璃棒来引流,故答案为:未用玻璃棒引流.
点评 本题是一道物质的分离和提纯的方法和基本操作的综合应用题,要求学生具有分析和解决问题的能力,难度中等.


科目:高中化学 来源: 题型:多选题
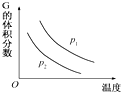 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )| A. | 正反应为放热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而减小 | D. | 增大压强,容器内气体的质量变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
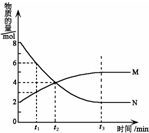 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为2 M?N | |
| B. | t1时N的浓度是M浓度的2倍 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水产生Al(OH)3 胶体,离子方程式可表示为:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 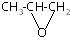 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在氧气中的燃烧反应 | B. | 铝与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 灼热的碳与二氧化碳的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com