
| A. | 都属于碱性氧化物 | B. | 溶于水后所得溶液的成分相同 | ||
| C. | 阴、阳离子个数比不同 | D. | 氧元素的化合价相同 |
分析 A.与水反应只生成碱的氧化物为碱性氧化物;
B.氧化钠与水反应生成氢氧化钠;过氧化钠与水反应生成氢氧化钠和氧气;
C.Na20是由钠离子和氧离子构成的离子化合物,电子式为 ,所以阳离子和阴离子数目之比都是2:1,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为
,所以阳离子和阴离子数目之比都是2:1,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为 ,则相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1;
,则相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1;
D.、过氧化钠中氧元素的化合价为-1价.
解答 解:A.过氧化钠与水反应生成氢氧化钠和氧气,不属于碱性氧化物,故A错误;
B.氧化钠与水反应生成氢氧化钠;过氧化钠与水反应生成氢氧化钠和氧气,水溶液的成分都是氢氧化钠,故B正确;
C.Na20是由钠离子和氧离子构成的离子化合物,电子式为 ,所以阳离子和阴离子数目之比都是2:1,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为
,所以阳离子和阴离子数目之比都是2:1,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为 ,则相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为2:1,故C错误;
,则相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为2:1,故C错误;
D.、过氧化钠的化学式为Na2O2,其中Na为+1价,氧的化合价为-1价,氧化钠中氧元素为-2价,故D错误;
故选:B.
点评 本题考查了物质的性质,为高考频考点,题目难度不大,熟悉氧化钠与过氧化钠的物理性质、化学性质是解题关键,注意碱性氧化物的定义.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
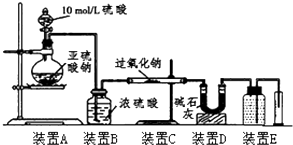
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用乙醇汽油作为汽车的燃料 | |
| B. | 洗涤衣物时使用无磷洗衣粉等洗涤剂 | |
| C. | 尽量减少塑料购物袋的使用 | |
| D. | 加大石油、煤炭的开采速度,增加化石的供应量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量为36.5 g/mol,O2的摩尔质量为16g/mol | |
| B. | 常温下,2.7克铝与足量的盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| D. | 标准状况下,11.2 L CCl4中含氯原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸均具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2气体使高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| B. | 在AgNO3的溶液中加入锌粉,能置换出银,说明AgNO3的还原性比Zn(NO3)2强 | |
| C. | 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com