
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
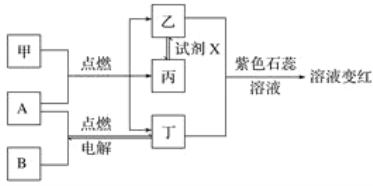
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
【答案】水 CO CO2+Ca(OH)2=CaCO3↓+H2O O2 CuO 充足的氧气 红色溶液变成紫色,有气泡冒出
【解析】
甲是天然气的主要成分,则甲是甲烷,甲与A,B与A能燃烧,则A是氧气,丁电解生成A、B,则B是氢气,丁是水,乙与水加入紫色石蕊试液后溶液变红,则乙是二氧化碳,丙与乙可以相互转化,则丙是一氧化碳,据此分析解答。
(1)根据分析可知丁是水,丙是CO,故答案为:水;CO;
(2)检验二氧化碳的方法是将气体通入澄清石灰水,反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)由丙转化到乙,则试剂X可以是氧气,也可以是氧化铜等物质,所属的类别分别是单质和氧化物;故答案为:O2;CuO;
(4)通过分析表明:燃料充分燃烧的条件之一是要有充足的氧气;故答案为:充足的氧气;
(5)取变红溶液于试管中加热会发生碳酸分解的过程,故可以观察到的现象是红色溶液变成紫色,有气泡冒出;故答案为:红色溶液变成紫色,有气泡冒出。


科目:高中化学 来源: 题型:
【题目】将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前,滤液中 FeSO4的物质的量浓度为
A.2 mol·L-1B.l.8 mol·L-1C.1.9 mol·L-1D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种钯(Pd)的氯配合物X的晶胞结构。回答下列问题:
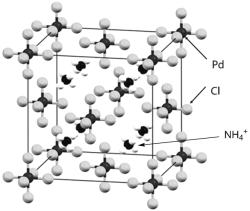
请回答下列问题:
(1)基态Cl原子中存在未成对电子的能级,画出其该能级的轨道表示式______。
(2)下列关于Cl元素的叙述正确的是______ (填序号)。
A.Cl2分子中无π键 B.Cl是p区主族元素
C.第一电离能:Cl<S D.电负性:Cl>S
(3)NCl3分子的中心原子N的杂化方式是______。
(4) NH3常作制冷剂,其键角______ (填“大于”或“小于”)NH4+的键角,NH3的沸点高于N2沸点的主要原因是______。
(5) 物质X的晶体类型为______,其中的Pd元素的化合价为______、配位数为______。
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比=1:2:2:6。试画出配合物Y的可能结构______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定溶液中大量共存的是
①无色溶液中:K+、Cl、Al3+、AlO2-、SO42-
②常温下,pH=14 的溶液中:CO32-、Na+、S2-、AlO2-
③室温下水电离的 c(H+)=10-13mol·L-1 的溶液:K+、HCO3-、Br-、Ba2+
④加入Al能放出H2的溶液中:NO3-、Cl-、Na+、SO42-
⑤中性溶液中:Cl-、NO3-、Na+、Fe3+
⑥室温下![]() =1012 的溶液中:Fe2+、Al3+、SO42-、I-.
=1012 的溶液中:Fe2+、Al3+、SO42-、I-.
A.①③⑥B.②④⑤C.②⑥D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某反应的能量关系图,下列叙述错误的是( )
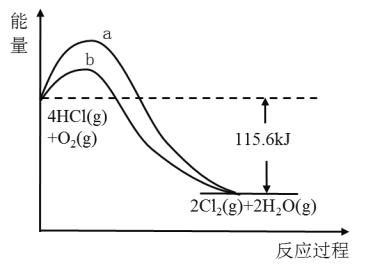
A.反应物总能量高于生成物的总能量
B.曲线b是使用了催化剂的能量变化曲线
C.反应的热化学方程式为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)+115.6kJ
2Cl2(g)+2H2O(g)+115.6kJ
D.若反应生成2mol液态水,放出的热量低于115.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
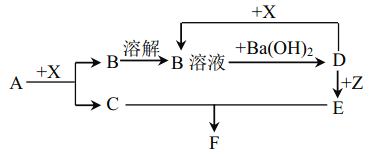
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com