
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
分析 ①⑤的最高价、最低价都是+4、-4,原子半径①<⑤,则①为C、⑤为Si;②⑧的最低价都是-1价,⑧没有最高正价,则⑧为F、②为Cl;③⑨的最高价都是+1,原子半径⑨>③>F,则③为Na、⑨为Li;⑦的最高价为+3,原子半径⑦>Si,则⑦为Al;④的最高价为+5,原子半径④<②(Li),则④为N元素;⑥的最高价为+6、最低价为-2,则⑥为S;⑩的最高价为+2,⑩的原子半径小于⑦(Al),则⑩为Be,据此结合元素周期律知识解答.
解答 解:①⑤的最高价、最低价都是+4、-4,原子半径①<⑤,则①为C、⑤为Si;②⑧的最低价都是-1价,⑧没有最高正价,则⑧为F、②为Cl;③⑨的最高价都是+1,原子半径⑨>③>F,则③为Na、⑨为Li;⑦的最高价为+3,原子半径⑦>Si,则⑦为Al;④的最高价为+5,原子半径④<②(Li),则④为N元素;⑥的最高价为+6、最低价为-2,则⑥为S;⑩的最高价为+2,⑩的原子半径小于⑦(Al),则⑩为Be,
(1)⑧为F、②为Cl,非金属性Cl<F,则氢化物稳定性:HCl<HF,
故答案为:HF;
(2)③为Na,⑥为S,最高价氧化物分别为氢氧化钠、硫酸,酸碱中和反应为放热反应,
故答案为:放热;
(3)①为C、⑤为Si,⑦为Al,三种元素的最高价氧化物对应水化物分别为H2CO3、H2SiO3、Al(OH)3,非金属性:C>Si>Al,则最高价氧化物对应水合物的酸性:H2CO3>H2SiO3>Al(OH)3,
故答案为:H2CO3>H2SiO3>Al(OH)3.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确元素周期表的结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
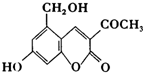 “亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:
“亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
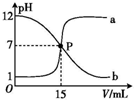 曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )
曲线 a 和 b 是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线.下列叙述中正确的是( )| A. | 盐酸的物质的量浓度与 NaOH 溶液的物质的量浓度相等 | |
| B. | P 点时溶液中 c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线 b 中滴定前 NaOH 溶液的体积为 150 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
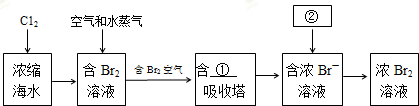
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com