
| A. | aL气体的平均相对分子质数为41.3 | |
| B. | aL气体被水吸收时转移电子的物质的量为($\frac{2m}{170}-\frac{b}{108}$)mol | |
| C. | cL剩余气体是O2,且c=$\frac{a}{4}$ | |
| D. | 将mgAgNO3溶于水,再加足量的盐酸,$\frac{b}{108}$×143.5g可生成沉淀 |
分析 A、由反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,混合气体中NO与O2的体积之比为2:1;
B、反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,生成氧气的物质的量为:$\frac{m}{170×2}$mol,根据得失电子守恒可余下氧气为$\frac{b}{108×4}$mol,而由方程式4NO2+O2+2H2O=4HNO3可知反应的氧气为:$\frac{m}{170×2}$-$\frac{b}{108×4}$,所以被水吸收时转移电子的物质的量为($\frac{2m}{170}-\frac{b}{108}$)mol;
C、因为4NO2+O2+2H2O=4HNO3,而所以氧气有剩余,NO2与O2的混合气体为a L,所以NO2的体积为:$\frac{2}{3}$aL,消耗氧气为:$\frac{\frac{2}{3}a}{4}$=$\frac{1}{6}$a;
D、根据银元素守恒可求得氯化银的质量.
解答 解:A、由反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,混合气体中NO与O2的体积之比为2:1,所以平均相对分子质量为$\frac{30×2+32}{3}$=30.67,故A错误;
B、反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,生成氧气的物质的量为:$\frac{m}{170×2}$mol,根据得失电子守恒可余下氧气为$\frac{b}{108×4}$mol,而由方程式4NO2+O2+2H2O=4HNO3可知反应的氧气为:$\frac{m}{170×2}$-$\frac{b}{108×4}$,所以被水吸收时转移电子的物质的量为($\frac{2m}{170}-\frac{b}{108}$)mol,故B正确;
C、因为4NO2+O2+2H2O=4HNO3,而所以氧气有剩余,NO2与O2的混合气体为a L,所以NO2的体积为:$\frac{2}{3}$aL,消耗氧气为:c=$\frac{\frac{2}{3}a}{4}$=$\frac{1}{6}$a,故C错误;
D、根据银元素守恒可求得氯化银的质量为$\frac{b}{108}$×143.5g,故D正确;
故选BD.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确二氧化氮和水反应中二氧化氮、氧气的比例关系是解本题关键,注意结合原子守恒解答问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
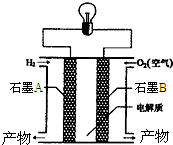 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | B电极上发生氧化反应 | |
| B. | A电极是负极 | |
| C. | 该电池的总反应为2H2+O2=2H2O | |
| D. | 外电路中电子由A电极通过导线流向B电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | 砹易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 砹是有色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).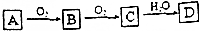
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Li、Na、K密度较小,应保存在煤油中 | |
| B. | CuO、Na2O、Mn2O7属于碱性氧化物 | |
| C. | SO2具有漂白性,可使溴水褪色 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4会产生沉淀而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

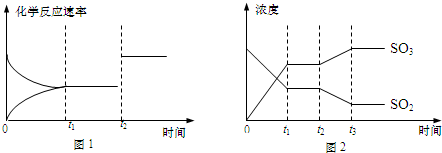
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
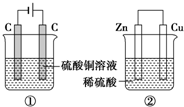 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com