
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
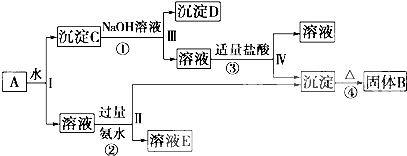
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L生理盐水(0.9% NaCl溶液)中含有9 mol Na+ |
| B、金属钠着火,可用干燥沙土盖灭 |
| C、浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 |
| D、氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | ||||
| B、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | ||||
| C、氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | ||||
D、用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-、NH4+、H+、Cl- |
| B、AlO2-、OH-、Na+、Cl- |
| C、AlO2-、H+、MnO42-、NO3- |
| D、Mg2+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
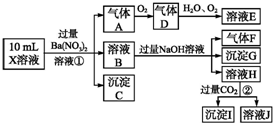
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、镀锌的铁比镀锡的铁耐用 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、铝片不用特殊方法保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com