
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)?C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
科目:高中化学 来源:2016-2017学年贵州省高一(3月)开学质检化学试卷(解析版) 题型:推断题
已知A、B、C、D、E、F为短周期元素,A的原子最外层电子数与其周期数相同,A在E中燃烧,发出苍白色火焰,产物溶于水得到一种强酸,F和E的电子层数相同,FD2能使品红溶液褪色。B的最外层电子数是其所在周期数的2倍,B在D中充分燃烧能生成其最高价化合物BD2,C和D加热条件下可以生成淡黄色化合物W,C+与D2-具有相同的电子数。回答下列问题:
(1)写出元素名称:A_________,B__________。
(2)F在元素周期表中位于第_________周期,第_________族。
(3)E与F相比,非金属性E______F(填“>”或“<”),下列事实能证明这一结论的是_______
A.E—的还原性比F2—强
B.HE比H2F稳定
C.酸性HE>H2F
D.元素E的最高正价为+7,元素F的最高正价为+6
(4)写出下列化学反应方程式
①W和BD2反应:_____________________________;
②A和E反应:_______________________________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省鞍山市高三3月月考理科综合化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法不正确的是
A. 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
B. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化
C. 在食品袋中放入盛有硅胶和铁粉的透气小袋,分别可防止食物受潮、氧化变质
D. 采用“静电除尘”“ 燃煤固硫”、“ 汽车尾气催化净化”可提高空气质量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次月考化学试卷(解析版) 题型:选择题
短周期元素a、b、c在周期表中位置关系如图所示,则 a、b、c三元素的名称是( )
a | ||
b | ||
c |
A. 氯、氟、硫 B. 氟、硫、砷 C. 氦、氟、硫 D. 氖、氯、硒
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次月考化学试卷(解析版) 题型:选择题
元素性质呈周期性变化的原因是 ( )
A. 相对原子质量逐渐增大 B. 核电荷数逐渐增大
C. 原子核外电子排布呈周期性变化 D. 元素的化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二3月月考化学试卷(解析版) 题型:选择题
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是
A. 将足量的CuSO4溶解在0.1mol·L-1的H2S溶液中,Cu2+的最大浓度为1.3×10-35 mol·L-1
B. 除去工业废水中的Cu2+可以选用FeS作沉淀剂
C. 因为H2SO4是强酸,所以反应CuSO4十H2S=CuS↓+H2SO4不能发生
D. 向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二3月月考化学试卷(解析版) 题型:选择题
化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A. 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B. 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C. 根据结构相似的分子的熔点与相对分子质量的关系,推出PH3比NH3熔点高
D. 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高一3月月考化学试卷(解析版) 题型:选择题
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
A. XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B. XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C. XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D. XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二下学期3月月考化学试卷(解析版) 题型:实验题
环己烯是一种重要的化工原料。
(1)实验室可由环己醇制备环己烯,反应的化学方程式是______________________________________________________。
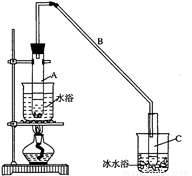
(2)实验装置如下图所示,将10 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
环己醇和环己烯的部分物理性质如下:
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
① A中碎瓷片的作用是_____________;导管B除了导气外还具有的作用是___________________。
② 试管A置于水浴中的目的是_________________________________;
试管C置于冰水浴中的目的是_______________________________。
(3)环己烯粗品中含有少量环己醇和酸性杂质。精制环己烯的方法是:
① 向环己烯粗品中加入_________(填入编号),充分振荡后,___________________(填操作名称)。
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
② 再对初步除杂后的环己烯进行蒸馏,得到环己烯精品。蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是__________________________。
③ 实验制得的环己烯精品质量低于理论产量,可能的原因是_______________。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是________________。
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com