
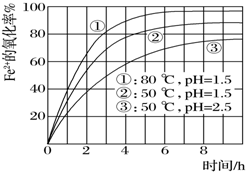
 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
分析 由图象知,当pH值等其它条件相同温度不同时,温度越高Fe2+的氧化率越大;当温度和其它条件相同PH值不同时,pH值越大,Fe2+的氧化率越小,据此分析解答.
解答 解:A.根据图象知,只有当温度和其它条件相同PH值不同时,pH值越小,Fe2+的氧化率越大,故A错误;
B.只有当pH值等其它条件相同温度不同时,温度越高Fe2+的氧化率越大,故B正确;
C.亚铁离子的氧化率不仅和温度、pH有关,还与离子的浓度等其它因素有关,故C正确;
D.根据图象知,降低pH、升高温度亚铁离子的氧化率增大,故D正确;
故选A.
点评 本题考查了外界条件对Fe2+氧化率的影响,难度不大,注意比较氧化率时,必须是其它条件相同只有一个条件不同时才能比较,否则无法得出结论.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com