
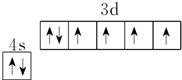
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
分析 A、根据金刚石的结构模型 判断;
判断;
B、石墨晶体层内是共价键,层与层之间是分子间作用力;
C.氯化铯晶体中,铯离子的配位数是8;
D.二氧化碳晶体中每个二氧化碳分子周围紧邻12个二氧化碳分子.
解答 解:A、金刚石的结构为 ,由模型可知最小的环为六元环,故A正确;
,由模型可知最小的环为六元环,故A正确;
B、石墨晶体层内是共价键,层与层之间是分子间作用力,故B错误;
C.根据氯化铯晶体晶胞结构知,每个晶胞中含有一个铯离子,每个顶点上的氯离子被8个晶胞共用,每个氯离子周围最近的铯离子是8,故C正确;
D.二氧化碳晶体属于面心立方,每个二氧化碳分子周围紧邻二氧化碳分子个数=3×8÷2=12,故D正确.
故选B.
点评 本题考查了晶体的空间结构,明确典型的晶体类型、结构、晶胞为解答本题关键,同时要求学生有丰富的空间想象能力,难度较大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑥ | C. | ②④⑤⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明乙醇分子中含有氢原子 | |
| B. | 说明乙醇分子中含有氧原子 | |
| C. | 说明乙醇分子中含有氢离子 | |
| D. | 说明乙醇分子中含有不同于烃分子里的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
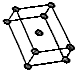
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
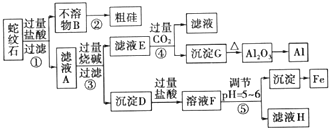
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com