
”¾ĢāÄæ”æÖŲøõĖįÄĘĖ׳Ęŗģ·ÆÄĘ![]() £¬ŹĒÖŲŅŖµÄ»Æ¹¤²śĘ·ŗĶĒæŃõ»Æ¼Į£®¹¤ŅµÖʱøŗģ·ÆÄʵÄĮ÷³ĢČēĻĀ£ŗ
£¬ŹĒÖŲŅŖµÄ»Æ¹¤²śĘ·ŗĶĒæŃõ»Æ¼Į£®¹¤ŅµÖʱøŗģ·ÆÄʵÄĮ÷³ĢČēĻĀ£ŗ
(1)»ÆѧÉĻæɽ«Ä³Š©ŃĪŠ“³ÉŃõ»ÆĪļµÄŠĪŹ½£¬Čē![]() æÉŠ“³É
æÉŠ“³É![]() £¬Ōņ
£¬Ōņ![]() æÉŠ“³É______£®
æÉŠ“³É______£®
(2)ģŃÉÕøõĢśæóŹ±£¬æóŹÆÖŠÄŃČܵÄ![]() Éś³ÉæÉČÜÓŚĖ®µÄ
Éś³ÉæÉČÜÓŚĖ®µÄ![]() £¬·“Ó¦»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
£¬·“Ó¦»Æѧ·½³ĢŹ½ČēĻĀ£ŗ![]() ĪŖĮĖ¼ÓæģøĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ______
ĪŖĮĖ¼ÓæģøĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ______![]() Š“Ņ»ÖÖ¼“æÉ
Š“Ņ»ÖÖ¼“æÉ![]()
(3)ŅŃÖŖ![]() ŌŚ²»Ķ¬µÄĖįŠŌČÜŅŗÖŠÓŠ²»Ķ¬µÄ·“Ó¦£¬Čē£ŗ
ŌŚ²»Ķ¬µÄĖįŠŌČÜŅŗÖŠÓŠ²»Ķ¬µÄ·“Ó¦£¬Čē£ŗ
![]() £»
£»![]()
¢ŁĶł»ģŗĻČÜŅŗ¼×ÖŠ¼ÓČėĮņĖį±ŲŠėŹŹĮæµÄŌŅņŹĒ______£®
¢Ś»ģŗĻČÜŅŗŅŅÖŠČÜÖŹµÄ»ÆѧŹ½ŹĒ______£®
(4)ŌŚŗ¬![]() ·ĻĖ®ÖŠ“ęŌŚ×ÅĘ½ŗā£ŗ
·ĻĖ®ÖŠ“ęŌŚ×ÅĘ½ŗā£ŗ![]() £¬ĒėŠ“³öøĆĘ½ŗāµÄĘ½ŗā³£Źż±ķ“ļŹ½
£¬ĒėŠ“³öøĆĘ½ŗāµÄĘ½ŗā³£Źż±ķ“ļŹ½![]() ______£¬Čō¼ĢŠų¼ÓĖ®Ļ”ŹĶ£¬Ę½ŗā½«______ŅʶÆ
______£¬Čō¼ĢŠų¼ÓĖ®Ļ”ŹĶ£¬Ę½ŗā½«______ŅʶÆ![]() Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±”°²»”±
Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±”°²»”±![]() £®
£®
(5)ĒėÅäĘ½¼īŠŌČÜŅŗ»¹Ō·ØÖŠ·¢ÉśµÄĄė×Ó·“Ó¦£ŗ
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() £®
£®
”¾“š°ø”æ![]() ·ŪĖéæóŹÆ”¢ÉżøßĪĀ¶Č ÉŁĮæ²»Äܳż¾”
·ŪĖéæóŹÆ”¢ÉżøßĪĀ¶Č ÉŁĮæ²»Äܳż¾”![]() µČŌÓÖŹ£¬¹żĮæ»įÉś³É
µČŌÓÖŹ£¬¹żĮæ»įÉś³É![]() µČø±²śĪļ
µČø±²śĪļ ![]() ŗĶ
ŗĶ![]()
![]() ÕżĻņ 4 6 19 8 3 14
ÕżĻņ 4 6 19 8 3 14
”¾½āĪö”æ
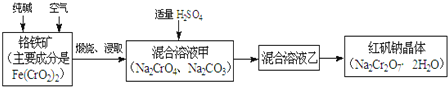
øõĢśæó¼ÓČė“æ¼ī£¬ĶØČėæÕĘųģŃÉÕ£¬¾½žČ”ŗóµĆµ½Na2CrO4”¢Na2CO3£¬¼ÓČėŹŹĮæĮņĖį£¬µĆµ½»ģŗĻČÜŅŗŅŅŗ¬ÓŠNa2Cr2O7ŗĶNa2SO4£¬Č»ŗó½į¾§æɵƵ½Na2Cr2O7¾§Ģ壬
£Ø1£©Ąą±ČNa2SiO3æÉŠ“³ÉNa2OSiO2Ķź³ÉFe£ØCrO2£©2µÄŃõ»ÆĪļµÄŠĪŹ½£»
£Ø2£©øł¾ŻÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ·ÖĪö£»
£Ø3£©¢Ł¹ĢĢåĶ¼Ź¾¼°ĢāÖŠŠÅĻ¢æÉÖŖ£¬ÉŁĮæ²»Äܳż¾”Na2CO3µČŌÓÖŹ£¬¹żĮæ»įÉś³ÉNa2Cr3O10µČø±²śĪļ£»
¢Ś·¢ÉśĮĖ·“Ó¦2CrO42-+2H+=Cr2O72-+H2O£¬Éś³ÉĮĖNa2Cr2O7ŗĶNa2SO4£»
£Ø4£©»ÆŃ§Ę½ŗā³£Źż£¬ŹĒÖøŌŚŅ»¶ØĪĀ¶ČĻĀ£¬æÉÄę·“Ó¦“ļµ½Ę½ŗāŹ±ø÷Éś³ÉĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»ż³żŅŌø÷·“Ó¦ĪļÅØ¶ČµÄ»Æѧ¼ĘĮæŹż“ĪĆŻµÄ³Ė»żĖłµĆµÄ±ČÖµ£¬Ė®²»ŠčŅŖŠ“³ö£¬¼ÓĖ®“Ł½ųĘ½ŗāÕżĻņŅĘ¶Æ£»
£Ø5£©Cr2O72-”śCr3+£¬S2-”śS2O32-£¬øł¾Żµē×Ó×ŖŅĘŹŲŗćÅäĘ½”£
øõĢśæó¼ÓČė“æ¼ī£¬ĶØČėæÕĘųģŃÉÕ£¬¾½žČ”ŗóµĆµ½Na2CrO4”¢Na2CO3£¬¼ÓČėŹŹĮæĮņĖį£¬µĆµ½»ģŗĻČÜŅŗŅŅŗ¬ÓŠNa2Cr2O7ŗĶNa2SO4£¬Č»ŗó½į¾§æɵƵ½Na2Cr2O7¾§Ģ壬
(1)Fe(CrO2)2ÖŠĢśŌŖĖŲ»ÆŗĻ¼ŪŹĒ+2¼Ū£¬Ńõ»ÆĪļĪŖFeO£¬øõŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū£¬Ńõ»ÆĪļĪŖCr2O3£¬ĖłŅŌFe(CrO2)2Š“³ÉŃõ»ÆĪļŠĪŹ½ĪŖFeOCr2O3£¬¹Ź“š°øĪŖ£ŗFeOCr2O3£»
(2)Ōö“ó·“Ó¦Īļ½Ó“„Ć껿æÉŅŌ¼Óæģ·“Ó¦ĖŁĀŹ£¬ÉżøßĪĀ¶ČæÉŅŌ“ó“ó¼Óæģ·“Ó¦ĖŁĀŹ£¬¹Ź“š°øĪŖ£ŗ·ŪĖéæóŹÆ”¢ÉżøßĪĀ¶Č£»
(3)¢ŁÓÉÓŚÉŁĮæÄŃŅŌ³ż¾”Ģ¼ĖįÄĘ£¬¹żĮæ»į·¢Éś·“Ó¦3CrO42+4H+=Cr3O102+2H2O£¬Éś³ÉĮĖNa2Cr3O10µČø±²śĪļ£¬ĖłŅŌ±ŲŠė¼ÓČėŹŹĮæĮņĖį£¬¹Ź“š°øĪŖ£ŗÉŁĮæ²»Äܳż¾”![]() µČŌÓÖŹ£¬¹żĮæ»įÉś³É
µČŌÓÖŹ£¬¹żĮæ»įÉś³É![]() µČø±²śĪļ£»
µČø±²śĪļ£»
¢ŚÓÉÓŚ·¢ÉśĮĖ·“Ó¦2CrO42+2H+=Cr2O72+H2O£¬Éś³ÉĮĖ![]() ŗĶ
ŗĶ![]() £¬ĖłŅŌŅŅÖŠČÜÖŹµÄ»ÆѧŹ½
£¬ĖłŅŌŅŅÖŠČÜÖŹµÄ»ÆѧŹ½![]() ŗĶ
ŗĶ![]() £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ![]() ŗĶ
ŗĶ![]() £»
£»
(4)øł¾Ż»ÆŃ§Ę½ŗā³£ŹżµÄ¶ØŅ壬æÉÖŖCr2O72(aq)+H2O(l)2CrO42(aq)+2H+(aq)µÄĘ½ŗā³£ŹżK=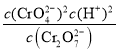 £¬¼ÓĖ®Ļ”ŹĶ£¬“Ł½ųĖ®½ā£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¹Ź“š°øĪŖ£ŗ
£¬¼ÓĖ®Ļ”ŹĶ£¬“Ł½ųĖ®½ā£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¹Ź“š°øĪŖ£ŗ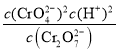 £»ÕżĻņ£»
£»ÕżĻņ£»
(5) Cr2O72”śCr3+£¬1mol Cr2O72»ńµĆµē×ÓĪļÖŹµÄĮæĪŖ1mol”Į2”Į(63)=6mol£¬S2”śS2O32£¬2molS2Ź§Č„µē×ÓĪļÖŹµÄĮæĪŖ1mol”Į2”Į[2(2)]=8mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć£¬×īŠ”¹«±¶ŹżĪŖ24£¬ĖłŅŌ·¢ÉśµÄĄė×Ó·“Ó¦ĪŖ£ŗ4Cr2O72+6S2+19H2OØT8Cr(OH)3”ż+3S2O32+14OH£¬¹Ź“š°øĪŖ£ŗ4”¢6”¢19”¢8”¢3”¢14”£


 53ĖęĢĆ²āĻµĮŠ“š°ø
53ĖęĢĆ²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŠĀŠĶ½āČČÕņĶ“æ¹Ń×Ņ©ĘĖŃ×Ķ“µÄ½į¹¹ČēĶ¼ĖłŹ¾£¬ĻĀĮŠ¹ŲÓŚĘĖŃ×Ķ“µÄŠšŹöÕżČ·µÄŹĒ
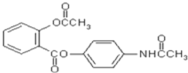
A.øĆĪļÖŹµÄ·Ö×ÓŹ½ĪŖ![]()
B.øĆĪļÖŹµÄŗĖ“Ź²ÕńĒāĘ×ÉĻ¹²ÓŠ9øö·å
C.øĆĪļÖŹÓėÅØäåĖ®·“Ӧɜ³É°×É«³Įµķ
D.øĆĪļÖŹŌŚĖįŠŌĢõ¼žĻĀĖ®½ā×īÖÕæÉŅŌµĆµ½4ÖÖĪļÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬Na2CO3ŗĶNaHCO3µÄ»ģŗĻČÜŅŗÖŠc(![]() )”¢c(
)”¢c(![]() )ÓėpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾[¼ŁÉčc(Na2CO3)+c(NaHCO3)=0.100 mol”¤L-1]”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
)ÓėpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾[¼ŁÉčc(Na2CO3)+c(NaHCO3)=0.100 mol”¤L-1]”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A.Ķ¼ÖŠEµćČÜŅŗ±ķŹ¾ÅØ¶Č¾łĪŖ0.05 mol”¤L-1µÄNa2CO3ŗĶNaHCO3ČÜŅŗ»ģŗĻŗóĖłµĆµ½µÄČÜŅŗ
B.pH=10µÄČÜŅŗÖŠ:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11µÄČÜŅŗÖŠ:c(![]() )<c(
)<c(![]() )
)
D.ĻņEµćČÜŅŗÖŠ¼ÓČėµČĢå»ż0.100 mol”¤L-1µÄNaOHČÜŅŗ£¬c(![]() )Óėc(
)Óėc(![]() )Ö®ŗĶ±£³Ö²»±ä
)Ö®ŗĶ±£³Ö²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌ±½ŗĶŅŅČ²ĪŖŌĮĻŗĻ³É»Æ¹¤ŌĮĻEµÄĀ·ĻßČēĻĀ£ŗ

»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŅŌĻĀÓŠ¹Ų±½ŗĶŅŅČ²µÄČĻŹ¶ÕżČ·µÄŹĒ ______
![]() ±½ŗĶŅŅČ²¶¼ÄÜŹ¹äåĖ®ĶŹÉ«£¬Ē°ÕßĪŖ»Æѧ±ä»Æ£¬ŗóÕßĪŖĪļĄķ±ä»Æ
±½ŗĶŅŅČ²¶¼ÄÜŹ¹äåĖ®ĶŹÉ«£¬Ē°ÕßĪŖ»Æѧ±ä»Æ£¬ŗóÕßĪŖĪļĄķ±ä»Æ
![]() ±½ŗĶŅŅČ²ŌŚæÕĘųÖŠČ¼ÉÕ¶¼ÓŠÅØŃĢ²śÉś
±½ŗĶŅŅČ²ŌŚæÕĘųÖŠČ¼ÉÕ¶¼ÓŠÅØŃĢ²śÉś
![]() ±½ÓėÅØĻõĖį»ģŗĻ£¬Ė®Ō”¼ÓČČ55”«60”ę£¬Éś³ÉĻõ»ł±½
±½ÓėÅØĻõĖį»ģŗĻ£¬Ė®Ō”¼ÓČČ55”«60”ę£¬Éś³ÉĻõ»ł±½
![]() ¾ŪŅŅČ²ŹĒŅ»ÖÖÓŠµ¼µēĢŲŠŌµÄøß·Ö×Ó»ÆŗĻĪļ
¾ŪŅŅČ²ŹĒŅ»ÖÖÓŠµ¼µēĢŲŠŌµÄøß·Ö×Ó»ÆŗĻĪļ
(2)AµÄĆū³Ę ______”£
(3)Éś³ÉBµÄ»Æѧ·½³ĢŹ½ĪŖ ______£¬·“Ó¦ĄąŠĶŹĒ ______”£
(4)CµÄ½į¹¹¼ņŹ½ĪŖ ______ £¬CµÄ·Ö×ÓÖŠŅ»¶Ø¹²ĆęµÄĢ¼Ō×Ó×ī¶ąÓŠ ______ øö”£
(5)ÓėDĶ¬Ąą±šĒŅÓŠ¶žøöĮłŌŖ»·½į¹¹(»·Óė»·Ö®¼äÓƵ„¼üĮ¬½Ó)µÄĶ¬·ÖŅģ¹¹ĢåÓŠ______ÖÖ£¬ĒėČĪŠ“Į½ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ______”£
(6)²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõŅŌŅŅČ²ŗĶ±ŲŅŖŹŌ¼ĮŗĻ³É»·±ūĶéµÄĀ·Ļߣŗ ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æE¾ßÓŠ¹ūĻćĪ¶£¬Óɳ£¼ūÓŠ»śĪļŗĻ³ÉEµÄĀ·ĻßČēĶ¼£¬Ēė»Ų“š£ŗ

(1)·“Ó¦¢ŁµÄ·“Ó¦ĄąŠĶ_______£¬CµÄĆū³Ę________£¬FÖŠŗ¬Ńõ¹ŁÄÜĶÅĆū³Ę________£»
(2)¼ģŃéĪļÖŹFĖłÓƵďŌ¼ĮĪŖ_____”£C×Ŗ»ÆĪŖDĖłÓƵďŌ¼ĮæÉŅŌŹĒ__________”£
(3)ĻĀĮŠ¹ŲÓŚĪļÖŹBµÄĖµ·ØÕżČ·µÄŹĒ________”£
A£®BĪŖ±½µÄĶ¬ĻµĪļ
B£®³£ĪĀ³£Ń¹ĻĀĪļÖŹB³ŹĘųĢ¬
C£®Ņ»¶ØĢõ¼žĻĀ£¬1 mol B×ī¶ąÄÜÓė4 mol H2·¢Éś¼Ó³É
D£®B¼ČÄÜŹ¹KMnO4ČÜŅŗĶŹÉ«ÓÖÄÜŹ¹Br2/CCl4 ČÜŅŗĶŹÉ«
(4) EŌŚĒāŃõ»ÆÄĘČÜŅŗÖŠĖ®½āµÄ»Æѧ·½³ĢŹ½ŹĒ___________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³ōŃõŹĒĄķĻėµÄŃĢĘųĶŃĻõŹŌ¼Į£¬ĘäĶŃĻõ·“Ó¦ĪŖ£ŗ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)”÷H<0£¬Čō·“Ó¦ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬Čē±ķÓÉøĆ·“Ó¦Ļą¹ŲĶ¼Ļó×÷³öµÄÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©
N2O5(g)+O2(g)”÷H<0£¬Čō·“Ó¦ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬Čē±ķÓÉøĆ·“Ó¦Ļą¹ŲĶ¼Ļó×÷³öµÄÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©
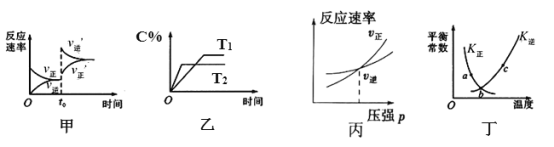
A.¼×Ķ¼ÖŠøıäµÄ·“Ó¦Ģõ¼žĪŖÉżĪĀ
B.ŅŅĶ¼ÖŠĪĀ¶ČT2>T1£¬×Ż×ų±źæÉ“ś±ķNO2µÄ°Ł·Öŗ¬Įæ
C.±ūĶ¼ĪŖ³äČėĻ”ÓŠĘųĢåŹ±ĖŁĀŹ±ä»Æ
D.¶”Ķ¼ÖŠa”¢b”¢cČżµćÖ»ÓŠbµćŅŃ¾“ļµ½Ę½ŗāדĢ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ŌĶæóŹĒŅ»ÖÖÖŲŅŖµÄĶæóŹÆ£¬Ö÷ŅŖŗ¬ÓŠĮņ»ÆŃĒĶ£ØCu2S£©£¬»¹ÓŠFe2O3”¢SiO2¼°Ņ»Š©²»ČÜŠŌŌÓÖŹ”£Ņ»ÖÖŅŌ»ŌĶæóŹÆĪŖŌĮĻÖʱøĻõĖįĶ¾§ĢåµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗ²æ·Ö½šŹōŃōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH·¶Ī§ČēĻĀ±ķĖłŹ¾£ØæŖŹ¼³ĮµķµÄpH°“½šŹōĄė×ÓÅضČĪŖ1.0mol/L¼ĘĖć£©
Ąė×Ó | æŖŹ¼³ĮµķµÄpH | ĶźČ«³ĮµķµÄpH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
»Ų“šĻĀĮŠĪŹĢā
£Ø1£©½žČ”ŗóµĆµ½µÄ½ž³öŅŗÖŠŗ¬ÓŠCuSO4”¢MnSO4”£Š“³ö½žČ”Ź±²śÉśCuSO4”¢MnSO4·“Ó¦µÄ»Æѧ·½³ĢŹ½__________”£
£Ø2£©µ÷½ŚpHµÄÄæµÄŹĒ___________£¬pHµÄµ÷½Ś·¶Ī§ĪŖ___________”£
£Ø3£©Éś³ÉMnCO3³ĮµķµÄĄė×Ó·½³ĢŹ½ĪŖ___________”£
£Ø4£©²Ł×÷AĪŖ___________”£
£Ø5£©ÓÉ»ŌĶæóÖĘČ”ĶµÄ·“Ó¦¹ż³ĢæÉŅŌ±ķŹ¾ĪŖ£ŗ
2Cu2S£Øs£©+3O2£Øg£©ØT 2Cu2O£Øs£©+ 2SO2£Øg£©”÷H=©768.2kJ/mol
2Cu2O£Øs£©+ Cu2S£Øs£©ØT 6Cu£Øs£©+ SO2£Øg£©”÷H=" +116.0" kJ/mol
ŌņÓÉCu2SÓėO2¼ÓČČ·“Ӧɜ³ÉCuµÄČČ»Æѧ·½³ĢŹ½ĪŖ___________”£
£Ø6£©ČōÓĆŗ¬85% Cu2S£ØMr=160£©µÄ»ŌĶæóĄ“ÖʱøĪŽĖ®Cu£ØNO3£©2£¬¼ŁÉč½žČ”ĀŹĪŖ95%£¬µ÷½ŚpHŹ±ĖšCu 3%£¬Õō°±¹ż³ĢÖŠÓŠ5%Ī“×Ŗ»ÆĪŖCuO£¬ĘäĖü¹ż³ĢÖŠĪŽĖšŗÄ£¬Ōņ1.6 kgÕāŃłµÄ»ŌĶæó×ī¶ąÄÜÖʱø__________molĪŽĖ®Cu£ØNO3£©2”£(¼ĘĖć½į¹ū¾«Č·µ½Š”Źżµćŗó1Ī»)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×Č©(HCHO)£¬ĪŽÉ«ĘųĢ壬Ņ×ČÜÓŚĖ®£¬ÓŠĢŲŹāµÄ“ĢĪ¢ĘųĪ¶£¬¶ŌČĖŃŪ”¢±ĒµČÓŠ“Ģ¼¤×÷ÓĆ”£40%¼×Č©ČÜŅŗ·ŠµćĪŖ96”ę£¬Ņ×»Ó·¢”£¼×Č©ŌŚ¼īŠŌČÜŅŗÖŠ¾ßÓŠ¼«ĒæµÄ»¹ŌŠŌ”£ĪŖĢ½¾æ¹żĮæ¼×Č©ŗĶŠĀÖĘCu(OH)2·“Ó¦µÄ²śĪļ³É·Ö£¬½ųŠŠČēĻĀŃŠ¾æ£ŗ
£Ø1£©ŌŚĻĀĶ¼×°ÖĆÖŠ½ųŠŠŹµŃ飬ĻņaÖŠ¼ÓČė0.5mol”¤L-1CuSO4ČÜŅŗ50mLŗĶ5 mol”¤L-1 NaOHČÜŅŗ100mL£¬Õńµ“£¬ŌŁ¼ÓČė40%µÄ¼×Č©ČÜŅŗ40mL£¬»ŗĀż¼ÓČČa£¬ŌŚ65”ꏱ»ŲĮ÷20·ÖÖÓŗóĄäČ“ÖĮŹŅĪĀ”£·“Ó¦¹ż³ĢÖŠ¹Ū²ģµ½ÓŠ×ŲÉ«¹ĢĢåÉś³É£¬×īŗó±ä³ÉŗģÉ«£¬²¢ÓŠĘųĢå²śÉś”£

¢ŁŅĒĘ÷bµÄĆū³ĘŹĒ____________”£
¢ŚŅĒĘ÷cµÄ×÷ÓĆĪŖ____________”£
¢ŪÄÜĖµĆ÷¼×Č©¾ßÓŠ»¹ŌŠŌµÄŹµŃéĻÖĻóŹĒ____________”£
£Ø2£©²éŌÄ׏ĮĻ·¢ĻÖĘųĢå²śĪļŹĒø±·“Ó¦²śÉśµÄ”£ĪŖČ·ČĻĘųĢå²śĪļÖŠŗ¬H2²»ŗ¬CO£¬½«×°ÖĆAŗĶČēĻĀĶ¼ĖłŹ¾µÄ×°ÖĆĮ¬½Óŗó½ųŠŠŹµŃ锣

¢ŁŅĄ“ĪĮ¬½ÓµÄŗĻĄķĖ³ŠņĪŖ£ŗA”śB”ś_____”ś_____”ś_____”ś_____”śG£¬________
¢Ś×°ÖĆBµÄ×÷ÓĆŹĒ_______________”£
¢ŪČ·ČĻĘųĢå²śĪļÖŠŗ¬H2¶ų²»ŗ¬COµÄĻÖĻóŹĒ_________________________”£
£Ø3£©ŅŃÖŖ£ŗ![]() ”£Ö¤Ć÷aÖŠ¼×Č©µÄĢ¼ŌŖĖŲĪ“±»Ńõ»Æ³É+4¼ŪµÄŹµŃé·½°øĪŖ£ŗȔɣĮæaÖŠ·“Ó¦ŗóµÄĒåŅŗ£¬____________________£¬ŌņĖµĆ÷¼×Č©µÄĢ¼ŌŖĖŲĪ“±»Ńõ»Æ³É+4¼Ū”£
”£Ö¤Ć÷aÖŠ¼×Č©µÄĢ¼ŌŖĖŲĪ“±»Ńõ»Æ³É+4¼ŪµÄŹµŃé·½°øĪŖ£ŗȔɣĮæaÖŠ·“Ó¦ŗóµÄĒåŅŗ£¬____________________£¬ŌņĖµĆ÷¼×Č©µÄĢ¼ŌŖĖŲĪ“±»Ńõ»Æ³É+4¼Ū”£
£Ø4£©ĪŖŃŠ¾æŗģÉ«¹ĢĢå²śĪļµÄ×é³É£¬½ųŠŠČēĻĀŹµŃé(ŅŌĻĀĆæ²½¾ł³ä·Ö·“Ó¦)£»

ŅŃÖŖ£ŗ¢”.Cu2O ![]() [Cu(NH3)4]+(ĪŽÉ«)
[Cu(NH3)4]+(ĪŽÉ«) ![]() [Cu(NH3)4]2+(Ą¶É«)
[Cu(NH3)4]2+(Ą¶É«)
¢¢.2Cu+8NH3”¤H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
ĶعżÉĻŹöŹµŃ飬æÉŅŌµĆ³öŗģÉ«¹ĢĢå²śĪļÖ÷ŅŖŹĒ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØČÜŅŗÖŠŅ»¶ØÄÜ“óĮæ¹²“ęµÄŹĒ( )
A.ÓÉĖ®µēĄė³öµÄH+ÅضČĪŖ1”Į10-9 mol/LµÄČÜŅŗÖŠ£ŗAl3+”¢![]() ”¢Na+”¢Cl-
ӢNa+ӢCl-
B.Óö·ÓĢŖ±äŗģµÄČÜŅŗÖŠ£ŗ![]() ”¢Na+”¢
ӢNa+Ӣ![]() ӢK+
ӢK+
C.c(![]() )=1mol/LµÄČÜŅŗÖŠ£ŗH+”¢Fe2+”¢Cl-”¢
)=1mol/LµÄČÜŅŗÖŠ£ŗH+”¢Fe2+”¢Cl-”¢![]()
D.pH=1µÄČÜŅŗÖŠ£ŗ![]() ”¢
Ӣ![]() ӢK+ӢCl-
ӢK+ӢCl-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com