
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | Fe2O3 |
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2CH2CH3的三个碳原子在一条直线 | |
| B. | CH2=CHCH3三个碳原子共平面 | |
| C. | 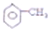 所有原子共平面 所有原子共平面 | |
| D. | CH4所有原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
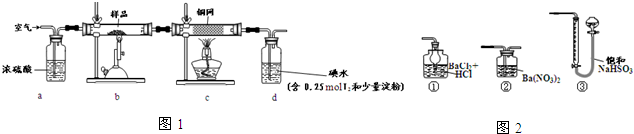
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y可能在同一周期 | B. | X在Y的前一周期 | ||
| C. | X一定是金属元素 | D. | X一定是第三周期ⅡA或ⅣA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
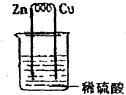
| A. | 铜片上的反应为:Cu-2e-=Cu2+ | B. | 锌片上的反应为:2H++2e-=H2↑ | ||
| C. | 锌片是负极,铜片是正极 | D. | 反应一段时间后,溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极反应为7O2+14 H2O+28e-→28OH- | |
| B. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 放电过程中KOH的物质的量浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑦ | C. | ④⑥⑦ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2使溴水褪色和使品红褪色原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com