
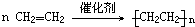 ,加聚反应的特点,双键变单键,断开的单键相连接形成高分子化合物,所以乙烯自身反应生成聚乙烯是加聚反应;可燃物完全燃烧时,其中碳元素全部生成二氧化碳、氢元素全部生成水,因此碳氢化合物CxHy,在空气中完全燃烧生成二氧化碳和水,该反应的化学方程式可表示为:4CxHy+(4x+y)O2
,加聚反应的特点,双键变单键,断开的单键相连接形成高分子化合物,所以乙烯自身反应生成聚乙烯是加聚反应;可燃物完全燃烧时,其中碳元素全部生成二氧化碳、氢元素全部生成水,因此碳氢化合物CxHy,在空气中完全燃烧生成二氧化碳和水,该反应的化学方程式可表示为:4CxHy+(4x+y)O2 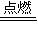 4xCO2+2yH2O;
4xCO2+2yH2O;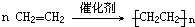 ;加聚;4CxHy+(4x+y)O2
;加聚;4CxHy+(4x+y)O2 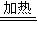 4xCO2+2yH2O.
4xCO2+2yH2O.

科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


| 2b |
| a |
| 2b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室通常用二氧化锰和浓盐酸反应制取Cl2。
(1)该反应的离子方程式为________________________________________________。
(2)甲、乙两同学用下列两种方法制取氯气:
甲:用含HCl
乙:用
则二者制得的Cl2(填序号)_______________。
①甲比乙多 ②乙比甲多 ③一样多 ④无法比较
Ⅱ.已知下列反应也可以生成氯气。
①2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2
2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
③2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
其中,适宜于实验室制取Cl2的反应是_____________(填序号,下同),适宜于工业上生产Cl2的反应是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室通常用二氧化锰和浓盐酸反应制取Cl2。
(1)该反应的离子方程式为____________________________________________。
(2)甲、乙两同学用下列两种方法制取氯气:
甲:用含HCl 146 g的浓盐酸与足量二氧化锰反应 乙:用87 g二氧化锰与足量浓盐酸反应
则二者制得的Cl2(填序号)___________。
①甲比乙多 ②乙比甲多 ③一样多 ④无法比较
Ⅱ.已知下列反应也可以生成氯气:
①2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2
2KCl+2MnCl2+5Cl2↑+8H2O ②4HCl+O2![]() 2Cl2+2H2O ③2NaCl+2H2O
2Cl2+2H2O ③2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
其中,适宜于实验室制取Cl2的反应是_____________(填序号,下同),适宜于工业上生产Cl2的反应是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com