
 HS-+OH-(2分)
HS-+OH-(2分) HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-。
H2S+OH-。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.原子半径A>C>B | B.离子半径B2—>C—>A+ |
| C.原子序数A>B>C | D.原子的电子总数B>C>A |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | (1) | | | | | | | (2) |
| 二 | | (3) | | (4) | | (5) | (6) | (7) |
| 三 | (8) | (9) | | | | | (10) | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子数相同,中子数不同的两种微粒 |
| B.质子数相同,中子数不同的两种原子 |
| C.质子数相同,中子数不同的两种离子 |
| D.质量数相同,中子数不同的两种原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三个短周期都含有8种元素 | B.三个长周期都含有18种元素 |
| C.七个副族都含有4种元素 | D.一个O族含有6种元素 |
查看答案和解析>>
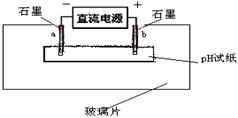
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期主族元素的原子序数越大越易失电子 |
| B.同周期主族元素的原子序数越大半径越大 |
| C.同主族元素的原子序数越大非金属性越强 |
| D.同主族元素的原子序数越大金属性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com