
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式___________________________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_____________________________。

(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)____________,它对环境的负面影响是_______________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是_______________________ _______。
_______。
解析 (1)形成硝酸型酸雨,这说明煤燃烧生成了NO和NO2等氮氧化物,NO与O2反应生成NO2,NO2与H2O反应生成HNO3。硝酸型酸雨有它的危害性,但它所含有的氮元素又是植物所需要的主要元素之一。因此应该一分为二地评价酸雨的利与弊。这里不是对NO和NO2的评价,而是对硝酸型酸雨的评价,该酸雨对臭氧层没有破坏作用。
(2)由图可知,脱硫使硫元素转化为CaSO4,最终产品是石膏CaSO4·2H2O。
(3)通过问题(2)的解答可知,在脱硫的同时生成了CO2,并且CO2与SO2以等物质的量代换。
(4)检验SO2的高效试剂是品红溶液,并且这里没有干扰因素。
答案 (1)①2NO+O2===2NO2,3NO2+H2O===2HNO3+NO ②a、b、d (2)CaCO3+SO2===CaSO3+CO2,2CaSO3+O2===2CaSO4,CaSO4+2H2O===CaSO4·2H2O (3)二氧化碳 使温室效应加剧,导致全球气候变暖 (4)将气体通入品红溶液观察品红溶液是否褪色,品红褪色,说明废气中还含有SO2;品红溶液不褪色,说明废气中不含SO2


科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3
B.向某溶液中加入稀硝酸再滴入Ba(NO3)2溶液产生白色沉淀,该溶液一定含SO42-
C.向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效
D.向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI)
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁的工艺流程可表示如下:
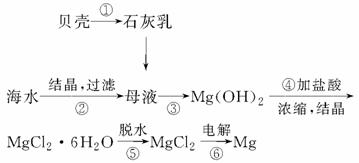
下列说法不正确的是
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是氧化镁和氯化镁的熔、沸 点数据:
点数据:
| 物质 | 氧化镁 | 氯化镁 |
| 熔点/℃ | 2 852 | 714 |
| 沸点/℃ | 3 600 | 1 412 |
请参考以上数据分析,从海水中提取镁,正确的方法是
A.海水 Mg(OH)2
Mg(OH)2 Mg
Mg
B.海水 MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融) Mg
Mg
C.海水 Mg(OH)2
Mg(OH)2 MgO
MgO Mg
Mg
D.海水 Mg(OH)2
Mg(OH)2 MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融) Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y均为短周期元素,X原子的最外层电子数是次外层电子数的2.5倍,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的分子式可表示为
A.XY B.XY2
C.XY3 D.XY4
查看答案和解析>>
科目:高中化学 来源: 题型:
美国夏威夷联合天文中心的科学家发现了氢的新微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A.是氢元素的一种新的同素异形体
B.是氢元素的一种新的同位素
C.该微粒的组成可用H3表示
D.该微粒比普通氢气分子多一个氢原子核
查看答案和解析>>
科目:高中化学 来源: 题型:
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,下列叙述正确的是( )
A.M的相对分子质量是180
B.1 mol M最多能与2 mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1 mol M与足量NaHCO3反应能生成2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
用于人造地球卫星的一种高能电池——银锌蓄电池,其电极式反应式为
Zn+2OH--2e-====ZnO+H2O
Ag2O+H2O+2e-====2Ag+2OH-
据此判断氧化银是( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com