
化学已经渗透到人类生活的各个方面,下列说法正确的是( )
A. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 氮的固定只有在高温、高压、催化剂的条件下才能实现
C. 服用铬含量超标的药用胶囊会对人体健康不会造成危害
D. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力 b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量───────────────────────────────────────。
②表中X可能为以上13种元素中的 (填写元素符号)元素。X和j原子个数比1:1形成化合物的电子式为 。
③Y是周期表中 族元素。
④以上13种元素中, (填写元素符号)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式: 。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3 mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序:r(Z)> r(R)> r(X) > r(Y)
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是___________________,有一种阳离子不能确定其是否存在,若要用实验证明该离子一定不存在,其最合理的化学方法是________________________________________________。
(2)写出下列反应的离子方程式:
①中生成气体A:___________________________________________________。
②生成沉淀I:______________________________________________________。
(3)假设测定A、F、I均为0.01mol, 10mLX溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定的离子是_______时,沉淀C物质的量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:K+、Ba2+、H+、Br-
B. 加入Al能放出H2的溶液中:K+、Na+、NO3-、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、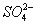 、S2-、
、S2-、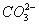
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度下,NaOH的溶解度为20克,该温度下将40克NaOH放入110克水中,充分搅拌后,测的溶液的密度为1.2g/mL,则溶液中溶质的物质的量浓度为( )。
A.5.0mol/L B.0.02mol/L C.2.0mol/L D.0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化通过一步反应不能实现的是 ( )
A.HCl →Cl2→HClO→NaClO B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3 D.Al→NaAlO2 →Al(OH)3→Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com