
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O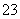 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O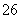 +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
科目:高中化学 来源: 题型:

去。经检测发现滤液中仍含有一定量的SO42—,其原因是
。【已知:Ksp(BaSO4)= 1.1 ×10—10 Ksp(BaCO3)= 5.1 ×10—9】
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有 (填化学式),发生器中生成ClO2的化学方程式为 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
 (D) +24NaClO3+12H2SO4=
(D) +24NaClO3+12H2SO4= ClO2↑+
ClO2↑+ CO2↑+18H2O+
CO2↑+18H2O+
(3)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。 处理含CN—相同时的电镀废水,所需Cl2的物质的量是ClO2的 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:KCl03+6HCl=KCl+3C12↑+3H20,若用K35C103和H37Cl作用,下列说法正确的是( ) A.KCl中只含35C1 B. KCl中只含37Cl
C. KCl中既含35C1又含37Cl D.被氧化和被还原的氯原子个数比为6 ∶ 1
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )。
A.Na2O2在上述反应中既作氧化剂又作还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
D.2 mol FeSO4发生反应时,共有8 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl Na2SO4 B.NaBr Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-====Cl-+HClO
B.向AlCl3溶液中滴加过量氨水制备Al(OH)3:
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
C.用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用FeCl3溶液腐蚀铜制印刷电路板:Fe3+ +Cu====Fe2++Cu2+
+Cu====Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7% B.20.0% C.80.0% D.83.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B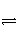
 C(g)+D,反应式中A和C都是无色气体。当反应达到平衡时,下列叙述错误的是( )
C(g)+D,反应式中A和C都是无色气体。当反应达到平衡时,下列叙述错误的是( )
A.若增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
B.若升高温度,C的百分含量减小,则说明正反应为放热反应
C.若增大压强平衡不发生移动,则说明B和D一定都是气体
D.如果B是气体,则增大A的浓度会使B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表达正确的是
①次氯酸的结构式为 H—Cl—O
②含有离子键的化合物都是离子化合物
③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物
A.①②④ B.①③⑤ C.②④⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com