
ĪŅ¹śŹĒøöøÖĢś“ó¹ś,øÖĢś²śĮæĪŖŹĄ½ēµŚŅ»,øßĀÆĮ¶ĢśŹĒ×īĪŖĘÕ±éµÄĮ¶Ģś·½·Ø”£
I.ŅŃÖŖ·“Ó¦ 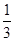 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
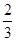 Fe(s)+ CO2(g) ¦¤H£½-23.5 kJ”¤mol-1£¬øĆ·“Ó¦ŌŚ
Fe(s)+ CO2(g) ¦¤H£½-23.5 kJ”¤mol-1£¬øĆ·“Ó¦ŌŚ
1000”ęµÄĘ½ŗā³£ŹżµČÓŚ4”£ŌŚŅ»øöČŻ»żĪŖ10LµÄĆܱÕČŻĘ÷ÖŠ,1000”ꏱ¼ÓČėFe”¢Fe2O3”¢CO”¢CO2ø÷1. 0mol,·“Ó¦¾¹żl0minŗó“ļµ½Ę½ŗā”£
£Ø1£©COµÄĘ½ŗā×Ŗ»ÆĀŹ=____________
£Ø2£©ÓūĢįøßCOµÄĘ½ŗā×Ŗ»ÆĀŹ,“Ł½ųFe2O3µÄ×Ŗ»Æ,æɲÉČ”µÄ“ėŹ©ŹĒ________
a£®Ģįøß·“Ó¦ĪĀ¶Č
b£®Ōö“ó·“Ó¦ĢåĻµµÄŃ¹Ēæ
c£®Ń”Č”ŗĻŹŹµÄ“߻ƼĮ
d£®¼°Ź±ĪüŹÕ»ņŅĘ³ö²æ·ÖCO2
e£®·ŪĖéæóŹÆ,Ź¹ĘäÓėĘ½ŗā»ģŗĻĘųĢå³ä·Ö½Ó“„
¢ņ.øßĀÆĮ¶Ģś²śÉśµÄ·ĻĘųÖŠµÄCOæɽųŠŠ»ŲŹÕ,Ź¹ĘäŌŚŅ»¶ØĢõ¼žĻĀŗĶH2·“Ó¦Öʱø¼×“¼:
CO(g)+ 2H2(g) CH3OH(g)”£Ēėøł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā:
CH3OH(g)”£Ēėøł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā,ÓĆH2ÅØ¶Č±ä»Æ±ķŹ¾Ę½¾ł·“Ó¦ĖŁĀŹv(H2)=________
£Ø2£©ČōŌŚĪĀ¶ČŗĶČŻĘ÷ĻąĶ¬µÄČżøöĆܱÕČŻĘ÷ÖŠ,°“²»Ķ¬·½Ź½Ķ¶Čė·“Ó¦Īļ,²āµĆ·“Ó¦“ļµ½Ę½ŗā
¼µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
| ČŻĘ÷ | ·“Ó¦ĪļĶ¶ČėµÄĮæ | ·“Ó¦ĪļµÄ ×Ŗ»ÆĀŹ | CH3OHµÄÅØ¶Č | ÄÜĮæ±ä»Æ (Q1”¢Q2”¢Q3¾ł“óÓŚ0) |
| ¼× | 1mol COŗĶ2mol H2 | ¦Į1 | c1 | ·Å³öQ1kJČČĮæ |
| ŅŅ | 1mol CH3OH | ¦Į2 | c2 | ĪüŹÕQ2kJČČĮæ |
| ±ū | 2mol COŗĶ4mol H2 | ¦Į3 | c3 | ·Å³öQ3kJČČĮæ |
I£®£Ø1£©60£„£Ø2·Ö£© £Ø2£©d£Ø2·Ö£©
¢ņ£®£Ø1£©0.15mol/(L”¤min) £Ø2·Ö£©£Øµ„Ī»³ö“ķøų1·Ö£©
£Ø2£© A D E (3·Ö£¬ÓŠ“ķŃ”²»µĆ·Ö)
¢ó£®£Ø1£© CH4 + 4O2”Ŗ ”Ŗ8e”Ŗ= CO2+ 2H2O£»£Ø2·Ö£©
£Ø2£© 1.12 L£Ø2·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗI.£Ø1£©ĮīĘ½ŗāŹ±COµÄĪļÖŹµÄĮæ±ä»ÆĪŖnmol£¬Ōņ£ŗ 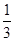 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
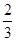 Fe(s)+ CO2(g)
Fe(s)+ CO2(g)
æŖŹ¼£Ømol£©£ŗ1 1
±ä»Æ£Ømol£©£ŗn n
Ę½ŗā£Ømol£©£ŗ1-n n+1
ĖłŅŌn+1/(1-n)=4£¬½āµĆn=0.6£¬ŌņCOµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ0.6mol/1mol”Į100%=60%£¬¹Ź“š°øĪŖ£ŗ60%£» (2)a£®øĆ·“Ó¦Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬Ģįøß·“Ó¦ĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦ŅĘ¶Æ£¬COµÄĘ½ŗā×Ŗ»ÆĀŹ½µµĶ£¬¹Źa“ķĪó£»b£®·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬¼õŠ”ČŻĘ÷µÄČŻ»ż£¬Ōö“óŃ¹ĒæĘ½ŗā²»ŅĘ¶Æ£¬COµÄĘ½ŗā×Ŗ»ÆĀŹ²»±ä£¬¹Źb“ķĪó£»c£®¼ÓČėŗĻŹŹµÄ“߻ƼĮ£¬Ę½ŗā²»ŅĘ¶Æ£¬¹Źc“ķĪó£»d£®ŅĘ³ö²æ·ÖCO2£¬Ę½ŗāĻņÕż·“Ó¦ŅĘ¶Æ£¬COµÄĘ½ŗā×Ŗ»ÆĀŹŌö“󣬹ŹdÕżČ·£»e£®·ŪĖéæóŹÆ£¬Ź¹ĘäÓėĘ½ŗā»ģŗĻĘųĢå³ä·Ö½Ó“„£¬Ę½ŗā²»ŅĘ¶Æ£¬¹Źe“ķĪó£»¹ŹŃ”d£» III£Ø1£©“ļµ½Ę½ŗāŹ±Éś³É¼×“¼ĪŖ£ŗ0.75mol/L£¬ŌņĻūŗĵÄc£ØH2£©=2”Į0.75mol/L=1.5mol/L£¬v£ØH2£©=”÷c/”÷t=1.5mol/L/10min=0.15mol/£ØL min£©£Ø2£©A”¢¼×”¢ŅŅĻą±Č½Ļ£¬°ŃŅŅµČŠ§ĪŖæŖŹ¼¼ÓČė1mol COŗĶ2mol H2£¬ŗĶ¼×ŹĒµČŠ§µÄ£¬¼×ŅŅŹĒµČŠ§Ę½ŗā£¬ĖłŅŌĘ½ŗāŹ±¼×“¼µÄÅضČc1=c2£¬¹ŹAÕżČ·£»B”¢¼×”¢±ūĻą±Č½Ļ£¬±ūÖŠ·“Ó¦ĪļµÄĪļÖŹµÄĮæĪŖ¼×µÄ2±¶£¬Ń¹ĒæŌö“󣬶ŌÓŚ·“Ó¦CO£Øg£©+2H2£Øg£© CH3OH£Øg£©£¬Ę½ŗāĻņÉś³É¼×“¼µÄ·½ĻņŅĘ¶Æ£¬¹Ź2Q1£¼Q3£¬¹ŹB“ķĪó£»C”¢¼×”¢±ūĻą±Č½Ļ£¬±ūÖŠ·“Ó¦ĪļµÄĪļÖŹµÄĮæĪŖ¼×µÄ2±¶£¬Ń¹ĒæŌö“󣬶ŌÓŚ·“Ó¦CO£Øg£©+2H2£Øg£©=CH3OH£Øg£©£¬Ę½ŗāĻņÉś³É¼×“¼µÄ·½ĻņŅĘ¶Æ£¬¹Źa1£¼a3 £¬¹ŹC“ķĪó£»D”¢¼×”¢ŅŅ“¦ÓŚĻąĶ¬µÄĘ½ŗāדĢ¬£¬¶ųĒŅ·“Ó¦·½ĻņĻą·“£¬Ōņ¦Į1+¦Į2="1" ,¹ŹDÕżČ·£»E”¢¼×”¢ŅŅ“¦ÓŚĻąĶ¬µÄĘ½ŗāדĢ¬£¬¶ųĒŅ·“Ó¦·½ĻņĻą·“£¬Į½øö·½Ļņ×Ŗ»ÆµÄŗĶĒ”ŗĆĪŖ1mol£¬ĖłŅŌøĆ·“Ó¦ČōÉś³É1mol CH3OH£¬Ōņ·Å³ö£ØQ1+Q2£©kJČČĮ棬¹ŹEÕżČ·£»¹Ź“š°øĪŖ£ŗADE£»¢ó£®£Ø1£©ĶØČėČ¼ĮĻ¼×ĶéµÄµē¼«ŹĒøŗ¼«£¬ĶØČėŃõĘųµÄµē¼«ŹĒÕż¼«”£øŗ¼«·¢ÉśµÄµē¼«Ź½ĪŖCH4 + 4O2”Ŗ”Ŗ8e”Ŗ= CO2+ 2H2O”££Ø2£©µē½āĮņĖįĶČÜŅŗŹ±Ńō¼«µÄµē¼«·“Ó¦Ź½4OH”Ŗ ”Ŗ4e”Ŗ= O2”ü+ 2H2O£¬Ņõ¼«µÄ·“Ó¦Ź½ŹĒ£ŗ Cu2++2e-=Cu£»2H++e-=H2”ü”£N(Cu)=0.1mol.ČōĮ½¼«ŹÕ¼Æµ½µÄĘųĢåĢå»żĻąµČ£¬ÉčĘäĪļÖŹµÄĮæĪŖX”£Ōņ4X=0.1”Į2+2X”£½āµĆX=0.1.ŌŚÕūøö·“Ó¦¹ż³Ģ×ŖŅʵē×ÓĻąµČ”£µē×ÓµÄĪļÖŹµÄĮæĪŖ0.4mol.ÓÉÓŚĆæĦ¶ū¼×Ķ鏧Ȅµē×Ó8Ħ¶ū£¬ĖłŅŌŠčŅŖ¼×ĶéµÄĪļÖŹµÄĮæĪŖ0.05Ħ¶ū”£V£ØCH4£©=0.05Ħ¶ū”Į22.4Éż/Ħ¶ū=1.12 Éż ”£Źµ¼ŹÉĻĻūŗĵļ×ĶéĢå»ż±ČĄķĀŪÉĻ“ó£¬æÉÄÜŌŅņŹĒ¼×Ķé²»ĶźČ«±»Ńõ»Æ£¬Éś³ÉC»ņCO »ņ µē³ŲÄÜĮæ×Ŗ»ÆĀŹ“ļ²»µ½100%”£
æ¼µć£ŗ±¾Ģā×ŪŗĻæ¼²éĮĖ»ÆŃ§Ę½ŗā”¢µē»ÆѧµČÖŖŹ¶£¬ĢāÄæ²ąÖŲÓŚµČŠ§Ę½ŗāµÄ¼ĘĖć£¬ĪŖøĆĢāµÄÄŃµć£¬Ņ²ŹĒŅדķµć£¬×¢ŅāĄķ½āµČŠ§Ę½ŗāĪŹĢā”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
æŖ·¢Ź¹ÓĆĒå½ąÄÜŌ“£¬·¢Õ¹”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā”£ĒāĘų”¢¼×“¼ŹĒÓÅÖŹµÄĒå½ąČ¼ĮĻ£¬æÉÖĘ×÷Č¼ĮĻµē³Ų”£
£Ø1£©¼×ĶéĖ®ÕōĘų×Ŗ»Æ·ØÖĘH2µÄÖ÷ŅŖ×Ŗ»Æ·“Ó¦ČēĻĀ£ŗ
CH4(g) + H2O(g) CO(g) + 3H2(g) ”÷H=+206£®2 kJ”¤mol£1
CO(g) + 3H2(g) ”÷H=+206£®2 kJ”¤mol£1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) ”÷H=+165£®0 kJ”¤mol£1
CO2(g) + 4H2(g) ”÷H=+165£®0 kJ”¤mol£1
ÉĻŹö·“Ó¦ĖłµĆŌĮĻĘųÖŠµÄCOÄÜŹ¹ŗĻ³É°±µÄ“߻ƼĮÖŠ¶¾£¬±ŲŠė³żČ„”£¹¤ŅµÉĻ³£²ÉÓĆ“ß»Æ¼Į“ęŌŚĻĀCOÓėĖ®ÕōĘų·“Ӧɜ³ÉŅ׳żČ„µÄCO2£¬Ķ¬Ź±æÉÖʵƵČĢå»żµÄĒāĘųµÄ·½·Ø”£“Ė·“Ó¦³ĘĪŖŅ»Ńõ»ÆĢ¼±ä»»·“Ó¦£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø2£©Éś²ś¼×“¼µÄŌĮĻCOŗĶH2Ą“Ō“ÓŚ£ŗCH4(g) + H2O(g)  CO(g) + 3H2(g) ¦¤H>0
CO(g) + 3H2(g) ¦¤H>0
¢ŁŅ»¶ØĢõ¼žĻĀCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼a”£ŌņA”¢B”¢CČżµć“¦¶ŌÓ¦Ę½ŗā³£Źż£ØKA”¢KB”¢KC£©µÄ“󊔹ŲĻµĪŖ___________”£(Ģī”°<”±”¢”°>”±”¢”°="”±" )£»
¢Ś100”ꏱ£¬½«1 mol CH4ŗĶ2 mol H2OĶØČėČŻ»żĪŖ1 LµÄ¶ØČŻĆÜ·āČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ__________
a£®ČŻĘ÷ÄŚĘųĢåĆܶČŗć¶Ø
b£®µ„Ī»Ź±¼äÄŚĻūŗÄ0£®1 mol CH4Ķ¬Ź±Éś³É0£®3 mol H2
c£®ČŻĘ÷µÄŃ¹Ēæŗć¶Ø
d£®3vÕż(CH4) = vÄę(H2)
£Ø3£©25”ꏱ£¬ŌŚ20mL0£®1mol/LĒā·śĖįÖŠ¼ÓČėVmL0£®1mol/LNaOHČÜŅŗ£¬²āµĆ»ģŗĻČÜŅŗµÄpH±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_____”£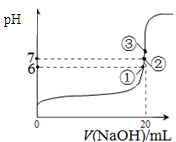
A£®pH£½3µÄHFČÜŅŗŗĶpH£½11µÄNaFČÜŅŗÖŠ£¬ ÓÉĖ®µēĄė³öµÄc(H+)ĻąµČ
B£®¢ŁµćŹ±pH£½6£¬“ĖŹ±ČÜŅŗÖŠ£¬c(F£)£c(Na+)£½9£®9”Į10-7mol/L
C£®¢ŚµćŹ±£¬ČÜŅŗÖŠµÄc(F£)£½c(Na+)
D£®¢ŪµćŹ±V£½20mL£¬“ĖŹ±ČÜŅŗÖŠc(Na+)£½0£®1mol/L
£Ø4£©³¤ĘŚŅŌĄ“£¬Ņ»Ö±ČĻĪŖ·śµÄŗ¬ŃõĖį²»“ęŌŚ”£1971ğƥ¹śæĘѧ¼ŅÓĆ·śĘųĶعżĻø±łÄ©Ź±»ńµĆHFO£¬Ęä½į¹¹Ź½ĪŖH”ŖO”ŖF”£HFOÓėĖ®·“Ó¦µĆµ½HFŗĶ»ÆŗĻĪļA£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
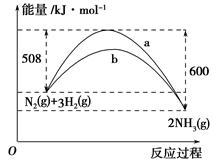
(1)¢Łøł¾ŻĻĀĮŠĶ¼Ź¾£¬Š“³ö·“Ó¦µÄČČ»Æѧ·½³ĢŹ½___________________________”£
¢Śøł¾ŻČēĶ¼ĖłŹ¾Ēéæö£¬ÅŠ¶ĻĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ________”£
| A£®ĘäČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCO(g)£«H2O(g)=CO2(g)£«H2(g)””¦¤H£½41 kJ”¤mol£1 |
| B£®øĆ·“Ó¦ĪŖĪüČČ·“Ó¦ |
| C£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦ |
| D£®µ±H2OĪŖŅŗĢ¬Ź±£¬Ęä·“Ó¦ČČÖµŠ”ÓŚ41 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
2013ğȫ¹śø÷µŲ¶¼ŌāÓö”°Ź®Ćęö²·ü”±”£ĘäÖŠ£¬»ś¶Æ³µĪ²ĘųŗĶČ¼Ćŗ²śÉśµÄŃĢĘų¶ŌæÕĘųÖŹĮæ¶ń»Æ¹±Ļ×½Ļ“ó”£
£Ø1£©Ęū³µĪ²Ęų¾»»ÆµÄÖ÷ŅŖŌĄķĪŖ£ŗ2NO(g) + 2CO(g) 2CO2(g)+ N2(g)”£”÷H£¼0
2CO2(g)+ N2(g)”£”÷H£¼0
ČōøĆ·“Ó¦ŌŚ¾ųČČ”¢ŗćČŻµÄĆܱÕĢåĻµÖŠ½ųŠŠ£¬ĻĀĮŠŹ¾ŅāĶ¼ÕżČ·ĒŅÄÜĖµĆ÷·“Ó¦ŌŚ½ųŠŠµ½t1Ź±æĢ“ļµ½Ę½ŗāדĢ¬µÄŹĒ £ØĢī“śŗÅ£©”£
£ØĻĀĶ¼ÖŠ¦ŌÕż”¢K”¢n”¢w·Ö±š±ķŹ¾Õż·“Ó¦ĖŁĀŹ”¢Ę½ŗā³£Źż”¢ĪļÖŹµÄĮæ”¢ÖŹĮæ·ÖŹż£©
£Ø2£©»ś¶Æ³µĪ²ĘųŗĶĆŗČ¼ÉÕ²śÉśµÄŃĢĘųŗ¬µŖµÄŃõ»ÆĪļ£¬ÓĆCH4“߻ƻ¹ŌNOXæÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾”£ŅŃÖŖ£ŗCH4(g)+2NO2(g)£½N2(g)£«CO2(g)+2H2O(g) ”÷H£½£867 kJ/mol
2NO2(g) N2O4(g) ”÷H£½£56.9 kJ/mol
N2O4(g) ”÷H£½£56.9 kJ/mol
H2O(g) £½ H2O(l) ¦¤H £½ £44.0 kJ£Æmol
Š“³öCH4“߻ƻ¹ŌN2O4(g)Éś³ÉN2ŗĶH2O(l)µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
£Ø3£©ÓĆNH3“߻ƻ¹ŌNOXŅ²æÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾”£ČēĶ¼£¬²ÉÓĆNH3×÷»¹Ō¼Į£¬ŃĢĘųŅŌŅ»¶ØµÄĮ÷ĖŁĶعżĮ½ÖÖ²»Ķ¬“߻ƼĮ£¬²āĮæŅŻ³öĘųĢåÖŠµŖŃõ»ÆĪļŗ¬Į棬“Ó¶ųČ·¶ØŃĢĘųĶѵŖĀŹ£Ø×¢£ŗĶѵŖĀŹ¼“µŖŃõ»ÆĪļ×Ŗ»ÆĀŹ£©£¬
·“Ó¦ŌĄķĪŖ£ŗNO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)”£
2N2(g) + 3H2O(g)ӣ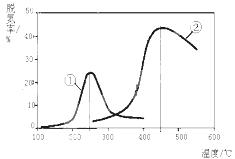
¢ŁøĆ·“Ó¦µÄ”÷S 0£¬”÷H 0£ØĢī”°£¾”±”¢”°£½”±»ņ ”°£¼”±£©”£
¢Ś¶ŌÓŚĘųĢå·“Ó¦£¬ÓĆij×é·Ö(B)µÄĘ½ŗāŃ¹Ēæ(pB)“śĢęĪļÖŹµÄĮæÅضČ(cB)Ņ²æÉŅŌ±ķŹ¾Ę½ŗā³£Źż£Ø¼Ē×÷KP£©£¬
ŌņÉĻŹö·“Ó¦µÄKP£½ ”£
¢ŪŅŌĻĀĖµ·ØÕżČ·µÄŹĒ ”£
A£®µŚ¢ŚÖ֓߻ƼĮ±ČµŚ¢ŁÖ֓߻ƼĮĶѵŖĀŹøß
B£®ĻąĶ¬Ģõ¼žĻĀ£¬øıäŃ¹Ēæ¶ŌĶѵŖĀŹĆ»ÓŠÓ°Ļģ
C£®“߻ƼĮ¢Ł”¢¢Ś·Ö±šŹŹŗĻÓŚ250”ęŗĶ450”ę×óÓŅĶѵŖ
£Ø4£©NO2”¢O2ŗĶČŪČŚNaNO3æÉÖĘ×÷Č¼ĮĻµē³Ų£¬ĘäŌĄķ¼ūĶ¼”£øƵē³ŲŌŚŹ¹ÓĆ¹ż³ĢÖŠŹÆÄ«Iµē¼«ÉĻÉś³ÉŃõ»ÆĪļY£¬Ęäµē¼«·“Ó¦ĪŖ ”£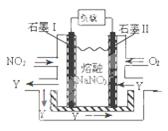
£Ø5£©ĻõĖį¹¤ŅµĪ²ĘųÖŠµŖŃõ»ÆĪļ£ØNOŗĶNO2£©æÉÓĆÄņĖŲ”²CO(NH2)2”³ČÜŅŗ³żČ„”£·“Ӧɜ³É¶Ō“óĘųĪŽĪŪČ¾µÄĘųĢ唣1 molÄņĖŲÄÜĪüŹÕ¹¤ŅµĪ²ĘųÖŠµŖŃõ»ÆĪļ£Ø¼ŁÉčNO”¢NO2Ģå»ż±ČĪŖ1:1£©µÄÖŹĮæĪŖ___________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¹¤ŅµÉĻÖʱøBaCl2µÄ¹¤ŅÕĮ÷³ĢĶ¼ČēĻĀ£ŗ
Ä³ŃŠ¾æŠ”×éŌŚŹµŃéŹŅÓĆÖŲ¾§ŹÆ£ØÖ÷ŅŖ³É·ÖBaSO4£©¶Ō¹¤Ņµ¹ż³Ģ½ųŠŠÄ£ÄāŹµŃ锣²é±ķµĆBaSO4(s) + 4C(s) 4CO(g) + BaS(s) ”÷H1£½£« 571.2 kJ”¤mol-1 ¢Ł
4CO(g) + BaS(s) ”÷H1£½£« 571.2 kJ”¤mol-1 ¢Ł
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ”÷H2£½£« 226.2 kJ”¤mol-1 ¢Ś
2CO2(g) + BaS(s) ”÷H2£½£« 226.2 kJ”¤mol-1 ¢Ś
(1)ĘųĢåÓĆ¹żĮæNaOHČÜŅŗĪüŹÕµĆµ½Įņ»ÆÄĘ”£Ņ»¶ØÅØ¶ČµÄĮņ»ÆÄĘČÜŅŗŅņĻņæÕĘųÖŠŹĶ·Å³ōĪ¶¶ų³ĘĪŖ”°³ō¼ī”±£¬ĻĀĮŠ¶ŌÕāŅ»ĻÖĻóµÄ½āŹĶÄćČĻĪŖ×īŗĻĄķµÄŹĒ £ØĢīŠņŗÅ£©
A£®Įņ»ÆÄĘŌŚĖ®ČÜŅŗÖŠĖ®½āÉś³ÉĮĖNaOHŗĶH2SĘųĢå
B£®Įņ»ÆÄĘČÜŅŗŅņĪüŹÕæÕĘųÖŠµÄŃõĘų±»Ńõ»ÆÉś³ÉĮĖNaOH£¬Ķ¬Ź±Éś³ÉÓŠ³ōĪ¶µÄĘųĢå
C£®Įņ»ÆÄĘČÜŅŗĖ®½āµÄ¹ż³ĢÖŠŅņĪüŹÕæÕĘųÖŠµÄCO2¶ų·Å³öH2SĘųĢå
(2)ĻņĶ¬ĪļÖŹµÄĮæÅضČBaCl2ŗĶKBr»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČėAgNO3ČÜŅŗ£¬ĻČÉś³É ³Įµķ£¬µ±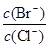 £½ Ź±£¬æŖŹ¼Éś³ÉµŚ¶žÖÖ³Įµķ£¬Ėę×ÅAgNO3ČÜŅŗµÄ½ųŅ»²½µĪ¼Ó£¬“ĖŹ±Éś³ÉµÄ³ĮµķŅŌ ĪŖÖ÷£¬ĒŅ
£½ Ź±£¬æŖŹ¼Éś³ÉµŚ¶žÖÖ³Įµķ£¬Ėę×ÅAgNO3ČÜŅŗµÄ½ųŅ»²½µĪ¼Ó£¬“ĖŹ±Éś³ÉµÄ³ĮµķŅŌ ĪŖÖ÷£¬ĒŅ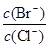 »į £ØĢī±ä“󔢱䊔”¢Ź¼ÖÕ²»±ä£©”£[ŅŃÖŖKsp(AgBr)£½5.4”Į10-13£¬Ksp(AgCl)£½2.0”Į10-10]
»į £ØĢī±ä“󔢱䊔”¢Ź¼ÖÕ²»±ä£©”£[ŅŃÖŖKsp(AgBr)£½5.4”Į10-13£¬Ksp(AgCl)£½2.0”Į10-10]
(3)·“Ó¦C(s) + CO2(g) 2CO(g)µÄ”÷H£½ kJ”¤mol-1”£
2CO(g)µÄ”÷H£½ kJ”¤mol-1”£
(4)Źµ¼ŹÉś²śÖŠ±ŲŠė¼ÓČė¹żĮæµÄĢ棬Ķ¬Ź±»¹ŅŖĶØČėæÕĘų£¬ĘäÄæµÄŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø1£© ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬²āµĆ0.1 mol”¤L£1CH3COOHČÜŅŗµÄPHĪŖ3.0”£ŌņCH3COOHŌŚĖ®ÖŠµÄµēĄėĪŖ £¬“ĖĪĀ¶ČCH3COOHµÄµēĄėĘ½ŗā³£ŹżĪŖ ”£
£Ø2£© ŌŚ25”ꏱ£¬Kw£½1.0”Į10£14£¬²āµĆ0.1 mol”¤L£1 Na2AČÜŅŗµÄpH£½7”£ŌņH2AŌŚĖ®ČÜŅŗÖŠµÄµēĄė·½³ĢŹ½ĪŖ £¬øĆĪĀ¶ČĻĀ£¬½«0.01 mol”¤L£1 H2AČÜŅŗĻ”ŹĶµ½20±¶ŗó£¬ČÜŅŗµÄpH£½ ”£
£Ø3£© ŅŃÖŖHCN(aq)+NaOH(aq)£½NaCN(aq)+ H2O(l) ¦¤H£½£12.1 kJ”¤mol£1£»
HCl(aq) +NaOH(aq)£½NaCl(aq) + H2O(l) ¦¤H£½£57.3 kJ”¤mol£1”£
ŌņŌŚĖ®ČÜŅŗÖŠHCN H++CN£µēĄėµÄ¦¤HĪŖ kJ”¤mol£1
H++CN£µēĄėµÄ¦¤HĪŖ kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
2013ÄźĪķö²ĢģĘų¶ą“ĪĖĮÅ°ĪŅ¹śÖŠ¶«²æµŲĒų”£ĘäÖŠ£¬Ęū³µĪ²ĘųŗĶČ¼ĆŗĪ²ĘųŹĒŌģ³ÉæÕĘųĪŪČ¾µÄŌŅņÖ®Ņ»”£
£Ø1£©Ęū³µĪ²Ęų¾»»ÆµÄÖ÷ŅŖŌĄķĪŖ£ŗ2NO(g)+2CO (g)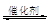 2CO2 (g) +N2 (g)ŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśøĆ·“Ó¦Ź±£¬c(CO2)ĖęĪĀ¶Č(T)”¢“߻ƼĮµÄ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬ČēĶ¼ĖłŹ¾”£¾Ż“ĖÅŠ¶Ļ£ŗ
2CO2 (g) +N2 (g)ŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśøĆ·“Ó¦Ź±£¬c(CO2)ĖęĪĀ¶Č(T)”¢“߻ƼĮµÄ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬ČēĶ¼ĖłŹ¾”£¾Ż“ĖÅŠ¶Ļ£ŗ
¢ŁøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ ”£
¢ŚøĆ·“Ó¦µÄ¦¤H 0£ØŃ”Ģī”°£¾”±”¢”°£¼”±£©”£
¢Ūµ±¹ĢĢå“߻ƼĮµÄÖŹĮæŅ»¶ØŹ±£¬Ōö“óĘä±ķĆ껿æÉĢįøß»Æ Ń§·“Ó¦ĖŁĀŹ”£Čō“߻ƼĮµÄ±ķĆ껿S1£¾S2£¬ŌŚĶ¼ÖŠ»³öc(CO2)ŌŚT2”¢S2Ģõ¼žĻĀ“ļµ½Ę½ŗā¹ż³ĢÖŠµÄ±ä»ÆĒśĻß”£
£Ø2£©Ö±½ÓÅÅ·ÅĆŗČ¼ÉÕ²śÉśµÄŃĢĘų»įŅżĘšŃĻÖŲµÄ»·¾³ĪŹĢā”£
¢Ł ĆŗČ¼ÉÕ²śÉśµÄŃĢĘųŗ¬µŖµÄŃõ»ÆĪļ£¬ÓĆCH4“߻ƻ¹ŌNOxæÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪ
Č¾”£
CH4(g)£«2NO2(g) = N2(g)£«CO2(g)£«2H2O(g) 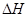 =£867kJ”¤mol£1
=£867kJ”¤mol£1
2NO2(g)  N2O4(g)
N2O4(g) 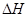 =£56.9kJ”¤mol£1
=£56.9kJ”¤mol£1
Š“³öCH4“߻ƻ¹ŌN2O4(g)Éś³ÉN2(g)”¢CO2(g)ŗĶH2O(g)µÄČČ»Æѧ·½³ĢŹ½ ”£
¢Ś½«Č¼Ćŗ²śÉśµÄ¶žŃõ»ÆĢ¼»ŲŹÕĄūÓĆ£¬æÉ “ļµ½µĶĢ¼ÅŷŵÄÄæµÄ”£ĻĀĶ¼ŹĒĶعż¹āµē×Ŗ»ÆŌĄķŅŌĮ®¼ŪŌĮĻÖʱøŠĀ²śĘ·µÄŹ¾ŅāĶ¼”£Š“³öÉĻŹö¹āµē×Ŗ»Æ¹ż³ĢµÄ»Æѧ·“Ó¦·½³ĢŹ½ ”£“߻ƼĮa”¢bÖ®¼äĮ¬½Óµ¼ĻßÉĻµē×ÓĮ÷¶Æ·½ĻņŹĒ (Ģīa”śb»ņb”śa) ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¹ś¼ŅÄāÓŚ”°Ź®¶žĪå”±ĘŚ¼ä½«SO2µÄÅÅ·ÅĮæ¼õÉŁ8%£¬ŃŠ¾æSO2×ŪŗĻĄūÓĆŅāŅåÖŲ“ó”£
£Ø1£©ŅŃÖŖ25”ꏱ£ŗSO2£Øg£©£«2CO£Øg£©£½2CO2£Øg£©£«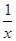 Sx£Øs£© ”÷H£½akJ/mol
Sx£Øs£© ”÷H£½akJ/mol
2COS£Øg£©£«SO2£Øg£©£½2CO2£Øg£©£«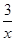 Sx£Øs£© ”÷H£½bkJ/mol”£
Sx£Øs£© ”÷H£½bkJ/mol”£
ŌņCOÓėSxÉś³ÉCOS·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ________________________”£
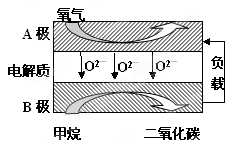
£Ø2£©ÓŠČĖÉčĻė°“ČēĶ¼ĖłŹ¾×°ÖĆÓĆ·ĻĘųÖŠµÄSO2Éś²śĮņĖį”£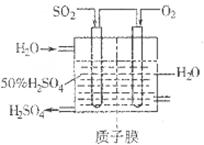
Š“³öSO2µē¼«µÄµē¼«·“Ó¦Ź½__________________________”£
£Ø3£©Ģįøß·“Ó¦2SO2£Øg£©£«O2£Øg£©  2SO3£Øg£© ”÷H£¼0ÖŠSO2µÄ×Ŗ»ÆĀŹŹĒæŲÖĘSO2ÅŷŵĹŲ¼ü“ėŹ©Ö®Ņ»”£Ä³æĪĶā»ī¶ÆŠ”×é½ųŠŠĮĖČēĻĀĢ½¾æ£ŗ
2SO3£Øg£© ”÷H£¼0ÖŠSO2µÄ×Ŗ»ÆĀŹŹĒæŲÖĘSO2ÅŷŵĹŲ¼ü“ėŹ©Ö®Ņ»”£Ä³æĪĶā»ī¶ÆŠ”×é½ųŠŠĮĖČēĻĀĢ½¾æ£ŗ
¢ŁT1ĪĀ¶ČŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė4.0molSO2ŗĶ2.0molO2£¬5 minŗó·“Ó¦“ļµ½Ę½ŗā£¬¶žŃõ»ÆĮņµÄ×Ŗ»ÆĀŹĪŖ50%£¬Ē°5 minÄŚSO2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ___________”£
¢ŚŌŚ¢ŁÖŠµÄ·“Ó¦“ļµ½Ę½ŗāŗó£¬øıäĻĀĮŠĢõ¼ž£¬ÄÜŹ¹SO2µÄ×Ŗ»ÆĀŹ¼°SO3µÄĘ½ŗāÅØ¶Č¶¼±ČŌĄ“Ōö“óµÄŹĒ
_________£ØĢīŠņŗÅ£©”£
a£®ĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬³äČė1.0molHe £Øg£©
b£®ĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬³äČė2molSO2ŗĶlmolO2
c£®ĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬³äČė1.0molSO2
d£®ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬¼õŠ”ČŻĘ÷µÄČŻ»ż
¢ŪŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬Ģ½¾æĘšŹ¼Ź±ŃõĘųĪļÖŹµÄĮæ¶Ō2SO2£Øg£©£«O2£Øg£©  2SO3£Øg£©·“Ó¦µÄÓ°Ļģ£¬ŹµŃé½į¹ūČēĶ¼ĖłŹ¾”££ØĶ¼ÖŠT±ķŹ¾ĪĀ¶Č£¬n±ķŹ¾ĪļÖŹµÄĮ棩£ŗŌŚa”¢b”¢cČżµćĖł“¦µÄĘ½ŗāדĢ¬ÖŠ£¬SO2µÄ×Ŗ»ÆĀŹ×īøߵďĒ____£¬ĪĀ¶ČT1______T2£ØĢī”°£¾”±”°£¼”±»ņ”°£½”±£©”£
2SO3£Øg£©·“Ó¦µÄÓ°Ļģ£¬ŹµŃé½į¹ūČēĶ¼ĖłŹ¾”££ØĶ¼ÖŠT±ķŹ¾ĪĀ¶Č£¬n±ķŹ¾ĪļÖŹµÄĮ棩£ŗŌŚa”¢b”¢cČżµćĖł“¦µÄĘ½ŗāדĢ¬ÖŠ£¬SO2µÄ×Ŗ»ÆĀŹ×īøߵďĒ____£¬ĪĀ¶ČT1______T2£ØĢī”°£¾”±”°£¼”±»ņ”°£½”±£©”£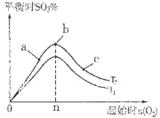
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌĖÓĆ»Æѧ·“Ó¦ŌĄķÖŖŹ¶ŃŠ¾æČēŗĪĄūÓĆCO”¢SO2µČĪŪČ¾ĪļÓŠÖŲŅŖŅāŅ唣
£Ø1£©ÓĆCOæÉŅŌŗĻ³É¼×“¼”£ŅŃÖŖ£ŗ
CH3OH(g)£«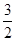 O2(g)=CO2(g)£«2H2O(l)””¦¤H£½£764.5 kJ”¤mol£1
O2(g)=CO2(g)£«2H2O(l)””¦¤H£½£764.5 kJ”¤mol£1
CO(g)£«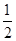 O2(g)=CO2(g)””¦¤H£½£283.0 kJ”¤mol£1
O2(g)=CO2(g)””¦¤H£½£283.0 kJ”¤mol£1
H2(g)£«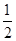 O2(g)=H2O(l)””¦¤H£½£285.8 kJ”¤mol£1
O2(g)=H2O(l)””¦¤H£½£285.8 kJ”¤mol£1
ŌņCO(g)£«2H2(g)  CH3OH(g)””¦¤H£½________kJ”¤mol£1
CH3OH(g)””¦¤H£½________kJ”¤mol£1
£Ø2£©ĻĀĮŠ“ėŹ©ÖŠÄܹ»Ōö“óÉĻŹöŗĻ³É¼×“¼·“Ó¦µÄ·“Ó¦ĖŁĀŹµÄŹĒ________(ĢīŠ“ŠņŗÅ)£®
a£®Ź¹ÓĆøߊ§“߻ƼĮ b£®½µµĶ·“Ó¦ĪĀ¶Č
c£®Ōö“óĢåĻµŃ¹Ēæ d£®²»¶Ļ½«CH3OH“Ó·“Ó¦»ģŗĻĪļÖŠ·ÖĄė³öĄ“
£Ø3£©ŌŚŅ»¶ØŃ¹ĒæĻĀ£¬ČŻ»żĪŖV LµÄČŻĘ÷ÖŠ³äČėa mol COÓė2a mol H2£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ·“Ӧɜ³É¼×“¼£¬Ę½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾”£
¢Łp1________p2(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)£»
¢Ś100 ”ꏱ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK£½________(mol”¤L£1)£2£»
¢ŪŌŚĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬ŌŁŌö¼Óa mol COŗĶ2a molH2£¬“ļµ½ŠĀĘ½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹ________(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
£Ø4£©Ä³æĘŃŠŠ”×éÓĆSO2ĪŖŌĮĻÖĘČ”ĮņĖį”£
¢ŁĄūÓĆŌµē³ŲŌĄķ£¬ÓĆSO2”¢O2ŗĶH2OĄ“ÖʱøĮņĖį£¬øƵē³ŲÓƶąæײÄĮĻ×÷µē¼«£¬ĖüÄÜĪüø½ĘųĢ壬Ķ¬Ź±Ņ²ÄÜŹ¹ĘųĢåÓėµē½āÖŹČÜŅŗ³ä·Ö½Ó“„”£ĒėŠ“³öøƵē³ŲµÄøŗ¼«µÄµē¼«·“Ó¦Ź½________________”£
¢ŚÓĆNa2SO3ČÜŅŗ³ä·ÖĪüŹÕSO2µĆNaHSO3ČÜŅŗ£¬Č»ŗóµē½āøĆČÜŅŗæÉÖʵĆĮņĖį”£µē½āŌĄķŹ¾ŅāĶ¼ČēĻĀĶ¼ĖłŹ¾”£ĒėŠ“³öæŖŹ¼Ź±Ńō¼«·“Ó¦µÄµē¼«·“Ó¦Ź½________________”£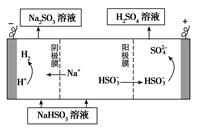
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com