
【题目】下列实验操作错误的是( )
A.分液漏斗使用前需要先检查是否漏液
B.试验中剩余的钠不能再放回原试剂瓶
C.做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D.蒸馏烧瓶加热时需要垫石棉网
科目:高中化学 来源: 题型:
【题目】碲(Te)是一种第VIA族分散稀有元素,主要伴生于铜、镍、铅等金属矿藏中。TeO2属于两性氧化物,难溶于水,易溶于强酸和强碱。工业上可从电解精炼铜的阳极泥(主要成分Cu2Te,还有少量的Ag、Au)中提取碲。其工艺流程如下:
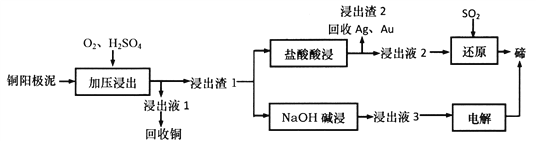
(1)“加压浸出”生成TeO2的离子方程式为________________________,“加压浸出”时控制pH为4.5~5.0,酸性不能过强的原因是_________________________________。
(2)“盐酸酸浸”后将SO2通入浸出液即可得到单质碲,该反应中氧化剂与还原剂物质的量之比为________________,该流程中可循环利用的物质是_____________(填化学式)。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgC1)=1.80×10-10。盐酸酸浸时,“浸出渣1”中Ag2SO4可充分转化为AgC1。通过计算说明为什么可以实现充分转化_________________。
(4)NaOH碱浸时反应的离子方程式为__________________。流程中,电解过程用石墨为电极得到碲,阴极的电极反应式为__________________________________。
(5)浸出法是工业提取金属常用的方法,某实验小组用1.0mol· L-1的草酸在75℃时浸出镍。随时间变化,不同固液比对镍浸出率的影响曲线如图所示。
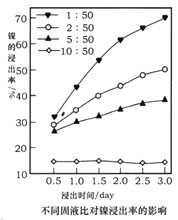
①由图可知,固液比与镍浸出率的关系是______________________。
②除固液比之外,你认为影响金属浸出率的因素还有____________________(至少两项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
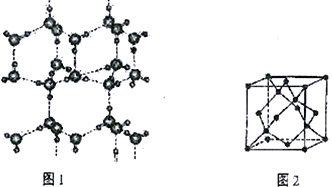
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是

A. 反应物微粒是S、SO32-、OH-
B. 3mol S参加反应时,转移的电子数3NA
C. 氧化剂与还原剂的物质的量之比为1:2
D. 该反应说明S2-和SO32-在碱性溶液中可以大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于人造地球卫星的一种高能电池——银锌蓄电池,其电极式反应式为Zn+2OH--2e-======ZnO+H2O Ag2O+H2O+2e-======2Ag+2OH-。据此判断氧化银是
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25 ℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是
A. 1×10-2 mol·L-1 B. 1×10-8 mol·L-1
C. 1×10-12 mol·L-1 D. 1×10-4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
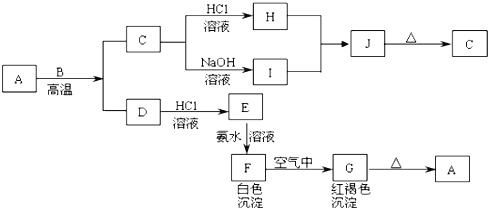
请回答下列问题
(1)写出下列物质的化学式A______,E_______,J________,G_______。
(2)F在空气中转化为G的化学方程式:______。
(3)C转化为I的离子方程式:______。
(4)H和I生成J的离子方程式:______。
(5)D在高温下和水蒸气反应的化学方程式:______。
(6)如何检验E中大量存在的阳离子?___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
(资料1)亚硫酸(H2SO3)易分解生成SO2和H2O。
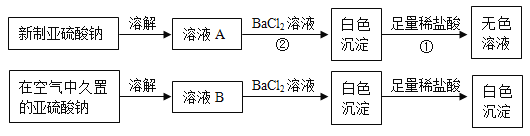
(1)写出上述实验中①、②的离子方程式_________________,_________________。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________(填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
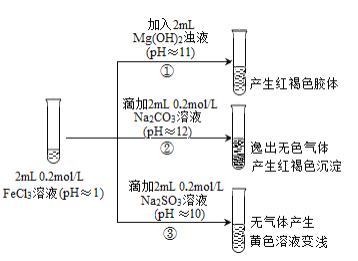
(资料2)含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________。
(2)②中逸出的无色气体是_______________________________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________。
(4)由上述实验可知,下列说法正确的是________(填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com