
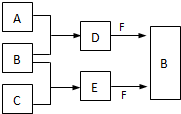
 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:分析 常温下D为无色液体,应为H2O,E是一种常见的温室气体,应为CO2,则A为H2,B为O2,C为C元素形成的单质,F为Na2O2,
(1)CO2为直线形分子;
(2)X与D生成Y的化学方程式是铁和水蒸气高温反应生成四氧化三铁和氢气;
(3)Z应为O3,与KI反应生成O2和I2.
解答 解:常温下D为无色液体,应为H2O,E是一种常见的温室气体,应为CO2,则A为H2,B为O2,C为C元素形成的单质,F为Na2O2,则
(1)E为CO2,
故答案为:CO2;
(2)单质X和B或D在一定条件下均能反应生成黑色磁性固体Y,判断生成的是四氧化三铁,说明X为铁与D为水蒸气反应生成Y四氧化三铁,反应的化学方程式为:
3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,Y为Fe3O4,
故答案为:Fe3O4;
(3)Z应为O3,与KI反应生成O2和I2,反应的离子方程式为O3+2H++2I-=O2+I2+H2O,
故答案为:O3+2H++2I-=O2+I2+H2O.
点评 本题考查了物质转化关系的分析判断,物质性质、反应现象的垃圾应用,掌握物质性质和特征反应是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中每生成2 mol AlN,N2得到3 mol | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝晶体属于分子晶体,熔点和沸点较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应均为氧化还原反应 | |
| B. | CO2与SO2不能用澄清石灰水鉴别 | |
| C. | CO2分子中各原子最外层均为8电子稳定结构 | |
| D. | 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
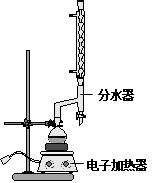 (改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
(改编)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高烟囱排放 | B. | 用氨水吸收后排放 | ||
| C. | 用烧碱吸收后排放 | D. | 用活性炭吸收后排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com