
| 物质 | NaCI | NH4HCO3 | NaHCO3 | NH4CI |
| S/g | 36.3 | 27.O | 11.1 | 41.1 |
| ||
| ||
| ||


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| B、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
| C、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b |
| B、常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为:③>①>② |
| C、常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 |
| D、物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
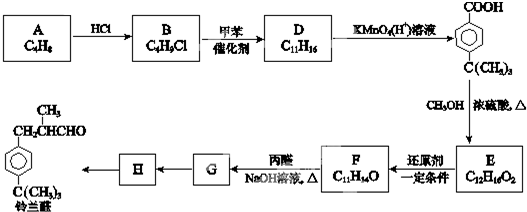
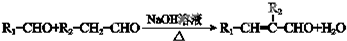
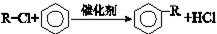
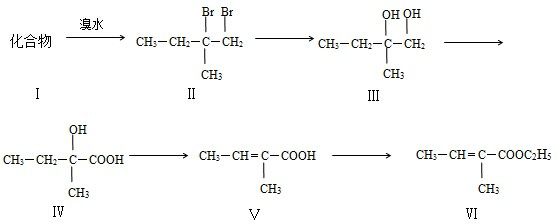
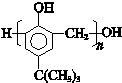 ,合成路线如图2,写出第三步的方程式:
,合成路线如图2,写出第三步的方程式: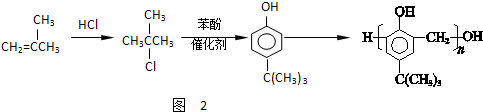
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉与稀H2SO4共热,再加银氨溶液水浴加热,无银镜生成,说明淀粉水解产物无还原性 | ||
B、SiO2+2C
| ||
| C、向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生,是因为两者都发生了水解反应,且相互促进 | ||
| D、将CO2通入Na2SiO3溶液中,有白色沉淀生成,证明H2CO3酸性比H2SiO3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制稀硫酸时将水倒入浓硫酸中并不断搅拌 |
| B、金属Na着火,立即用水扑灭 |
| C、大量氯气泄漏时,迅速离开现场并尽量往高处去 |
| D、皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 漂白粉需密封保存 | 因为潮湿条件下易与CO2反应 |
| B | 铁船船体上镶嵌锌块以防船体被腐蚀 | 因为锌能从铁盐溶液中置换出铁 |
| C | 高压钠灯发出透雾性强的黄光 | 因为金属钠具有强还原性 |
| D | 铁或铝制槽车可以密封贮运浓硫酸 | 因为铁和铝不能与浓硫酸反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com