
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A. | Cu与Al | B. | Fe与Cu | C. | Fe与Na | D. | Al与Na |
分析 由合金的形成可知,两种金属若能够形成合金,则熔点较高的金属的熔点不能大于熔点较低的金属的沸点.
解答 解:合金是不同种金属在熔化状态下形成的一种熔合物,即两种金属都成为液态时进行混合;
A.铜的熔点低于铝的沸点,两种金属能够形成合金,故A错误;
B.铁的熔点低于铜的沸点,两种金属能够形成合金,故B错误;
C.由于金属钠的沸点较低,铁的熔点1535℃高于钠的沸点883℃,在铁熔化时温度达1535℃,而此时金属钠已变成气态,无法完成液态时混合,故钠和铁不能形成合金,故C正确;
D.铝的熔点低于钠的沸点,两种金属能够形成合金,故D错误;
故选C.
点评 本题考查了合金的形成条件,题目难度不大,注意制造合金时,两种金属必须都是液态才能制成合金,一种液态、一种气态不会转化成合金.


科目:高中化学 来源: 题型:选择题
| A. | N2与H2在一定条件下合成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3被O2氧化成NO和H2O | D. | 由NH3制备化肥NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
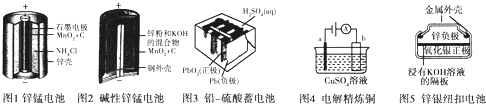
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | A的浓度不再变化 | ||
| C. | 正逆反应速率相等 | D. | C的质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
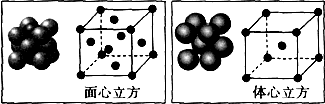
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
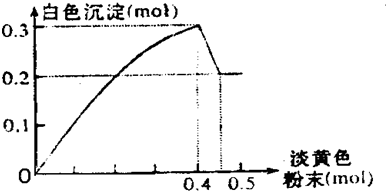
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com