
| A. | GQXYZ | B. | XYGQZ | C. | GYQZX | D. | GXQYZ |
分析 G、Q、X、Y、Z均为氯的含氧化合物,根据氧化还原反应中Cl元素的化合价升降来分析,氧化还原反应中元素的化合价有升高,则必然有降低,以此来解答.
解答 解:①G→Q十NaCl中,NaCl中Cl元素为-1价,则Cl元素的化合价为Q>G>-1,
③Y十NaOH→G十Q十H2O中,结合①可知Cl元素的化合价为Q>Y>G,
②Q+H2O→X+H2中,H元素的化合价降低,则Cl元素的化合价升高,所以Cl元素的化合价为X>Q,
④Z十NaOH→Q十X十H2O中,结合②可知,Cl元素的化合价为X>Z>Q,
所以五种化合物中氯的化合价由低到高的顺序为GYQZX,
故选C.
点评 本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,题目难度不大.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O2和Na2O | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuCO3<Cu(OH)2<CuS | C. | CuS<CuCO3<Cu(OH)2 | D. | Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
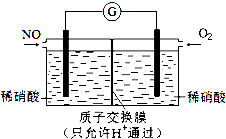 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 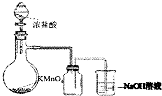 实验室制取并收集Cl2 | B. | 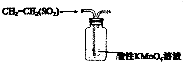 检验乙烯中是否含有SO2 | ||
| C. | 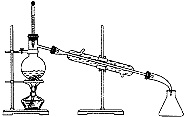 分离Br2和H20的混合物 | D. | 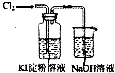 验证氧化性Cl>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com