
| A£® | CO£Øg£© ÓėNa2O2£Øs£©·“Ó¦·Å³ö509kJČČĮæŹ±£¬µē×Ó×ŖŅĘŹżĪŖ6.02”Į1023 | |
| B£® | 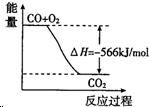 Ķ¼æɱķŹ¾ÓÉCOÉś³ÉCO2µÄ·“Ó¦¹ż³ĢŗĶÄÜĮæ¹ŲĻµ | |
| C£® | 2Na2O2£Øs£©+2CO2£Øs£©ØT2Na2CO3£Øs£©+O2£Øg£©”÷H£¾-452kJ/mol | |
| D£® | COµÄČ¼ÉÕČČĪŖ283kJ |
·ÖĪö A£®ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½£¬½įŗĻøĒĖ¹¶ØĀɼĘĖćµĆµ½ČČ»Æѧ·½³ĢŹ½¼ĘĖć·ÖĪö£»
B£®øł¾Ż”°¶ĢĻßÉĻĖµĆ÷µÄĪļÖŹ”±²»½ö½ö“ś±ķµÄŹĒ·“Ó¦Īļ»ņÕßÉś³ÉĪļ£¬¶ųĘä¶ŌÓ¦µÄĻµŹż“ś±ķµÄŹĒ²Ī¼Ó·“Ó¦µÄĪļÖŹµÄĮ棻
C£®øł¾ŻČČ»Æѧ·½³ĢŹ½ÖŠČČĮæÓėĪļÖŹµÄĮæÖ®¼äµÄ¹ŲĻµ”¢ĪļÖŹÓɹĢĢ¬±äĘųĢ¬ĪüŹÕČČĮæŅŌ¼°øĒĖ¹¶ØĀÉĄ“½ā“š£»
D£®øł¾ŻČ¼ÉÕČȵÄøÅÄīŅŌ¼°Č¼ÉÕČȵĵ„Ī»·ÖĪö£¬COµÄČ¼ÉÕČČĪŖ283 kJ/mol£®
½ā“š ½ā£ŗA£®ĢāÄæÖŠ$\frac{1Ź½}{2}$+2Ź½ĪŖ£ŗNa2O2£Øs£©+CO£Øg£©=Na2CO3£Øs£©”÷H=-509 kJ/mol£¬“ĖŹ±·ÅČČ509KJ£¬ŅņĪŖCOŹĒ1mol£¬ĖłŅŌ×ŖŅʵē×ÓŹżŹĒ2±¶µÄ6.02”Į1023£¬¹ŹA“ķĪó£»
B£®øĆĶ¼ĆčŹöµÄ¾ĶŹĒŅ»øöČČ»Æѧ·½³ĢŹ½£¬ĖłŅŌ¶ŌÓ¦566µÄŹżÖµÓ¦øĆŹĒ2CO£Øg£©+O2£Øg£©ŗĶ2CO2£¬ÉĻ±ßµÄĻµŹż²»¶Ō£¬¹ŹB“ķĪó£»
C£®ĢāÄæÖŠµŚ¶žøö·½³ĢµÄ2±¶ĪŖ£ŗ2Na2O2£Øs£©+2CO2£Øg£©=2Na2CO3£Øs£©+O2£Øg£©”÷H=-452 kJ/mol£¬±¾ĢāÖŠµÄCO2£Øs£©¶ąŅ»²½±äĘųĢåĪüČČµÄ¹ż³Ģ£¬ĖłŅŌ±¾Ģā·Å³öµÄČČĮæ¾ĶÉŁÓŚ452£¬µ«ŹĒ”÷H£¾-452 kJ/mol£¬¹ŹCÕżČ·£»
D£®Č¼ÉÕČČŹĒ1molæÉČ¼ĪļĶźČ«Č¼ÉÕÉś³ÉĪȶØŃõ»ÆĪļŹ±·Å³öČČĮ棬2CO£Øg£©+O2£Øg£©=2CO2£Øg£©”÷H=-566kJ/mol£»Ņ»Ńõ»ÆĢ¼µÄČ¼ÉÕČČĪŖ283KJ/mol£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éĮĖČČ»Æѧ·½³ĢŹ½µÄ¼ĘĖćÓ¦ÓĆ£¬øĒĖ¹¶ØĀɵÄÓ¦ÓĆ£¬Č¼ÉÕČČøÅÄī¼ĘĖć·ÖĪö£¬ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“·½·ØŗĶ¼ĘĖćÓ¦ÓĆŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 Ņ»ÅµŹéŅµŹī¼Ł×÷ŅµæģĄÖ¼ŁĘŚŌĘÄĻĆĄŹõ³ö°ęÉēĻµĮŠ“š°ø
Ņ»ÅµŹéŅµŹī¼Ł×÷ŅµæģĄÖ¼ŁĘŚŌĘÄĻĆĄŹõ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč”¢Ō¤ĘŚĻÖĻó | ½įĀŪ |
| ¢ŁĻņČÜŅŗÖŠ¼ÓČėĖÄĀČ»ÆĢ¼£¬²Ł×÷Õńµ“”¢¾²ÖĆ£¬ ĻÖĻóCCl4²ć³Ź³ČŗģÉ«£¬Ė®²ć³ŹĪŽÉ« | ¼ŁÉč1ÕżČ· |
| ¢ŚĻņČÜŅŗÖŠĮķČėKSCNČÜŅŗ£¬ ĻÖĻóČÜŅŗ±äĪŖŗģÉ« | ¼ŁÉč2ÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
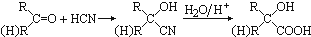 £¬COŗĶH2°“ĪļÖŹµÄĮæÖ®±Č1£ŗ2æÉŅŌÖʵĆG£¬ÓŠ»ś²£Į§æÉ°“ĻĀĮŠĀ·ĻßŗĻ³É£ŗ
£¬COŗĶH2°“ĪļÖŹµÄĮæÖ®±Č1£ŗ2æÉŅŌÖʵĆG£¬ÓŠ»ś²£Į§æÉ°“ĻĀĮŠĀ·ĻßŗĻ³É£ŗ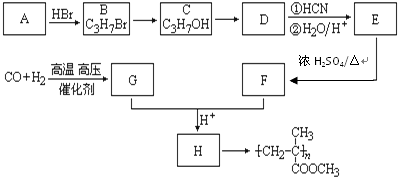
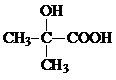 £»
£» £»
£»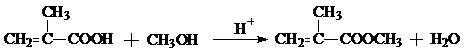 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ӦєÓĆ100mLČŻĮæĘæ | |
| B£® | ÅäÖĆÖ®Ē°ČŻĮæĘæÖŠ²ŠĮōµÄÕōĮóĖ®»įµ¼ÖĀÅضČĘ«øß | |
| C£® | ¶ØČŻŹ±øÆŹ“æĢ¶Č»įµ¼ÖĀÅضČĘ«µĶ | |
| D£® | Ņ”ŌČ”¢¾²ÖĆŗó·¢ĻÖ°¼ŅŗĆęµĶÓŚæĢ¶ČĻߣ¬ŌŁ¼ÓĖ®ÖĮæĢ¶ČĻß¼“æÉ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 µŖæÉŅŌŠĪ³É¶ąÖÖ»ÆŗĻĪļ£¬ČēNH3”¢N2H4”¢HCN”¢NH4NO3µČ£®
µŖæÉŅŌŠĪ³É¶ąÖÖ»ÆŗĻĪļ£¬ČēNH3”¢N2H4”¢HCN”¢NH4NO3µČ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
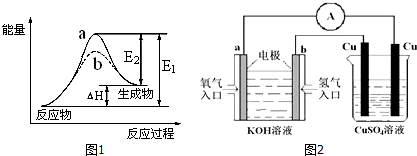
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com