
【题目】NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1 mol Na2O2 完全电离出的离子数目为3 NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数 ![]()
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为 NA
数为 NA
【答案】B
【解析】解:A、Na2O2 在熔融状态下电离出2个钠离子和1个过氧根,故1mol过氧化钠能电离出3mol离子即3NA个,故A正确;
B、将二氧化碳通过过氧化钠固体,固体增加的质量相当于对已CO的质量反应中转移电子数为 ![]() NA , 故B错误;
NA , 故B错误;
C、标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA , 故C正确;
D、加入一定量的氨水后,溶液呈中性,n(H+)=n(OH﹣),据溶液中的电荷守恒:n(Cl﹣)+n(OH﹣)=n(NH![]() )+n(H+),所以n(Cl﹣)=n(NH
)+n(H+),所以n(Cl﹣)=n(NH![]() )=1mol,即铵根离子为NA个,故D正确.
)=1mol,即铵根离子为NA个,故D正确.
故选B.


科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害,某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源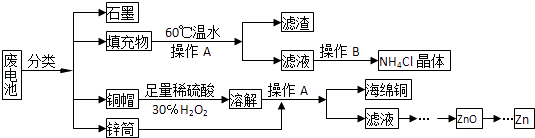
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示).铜帽溶解完全后,可采用方法除去溶液中过量的H2O2 .
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.①当1molMnO2参加反应时,整个反应共有mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.
(1)若A是一种红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是 , B在反应中表现出的性质是、 .
(2)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式;实验室检验C的方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgOB2O3H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图: 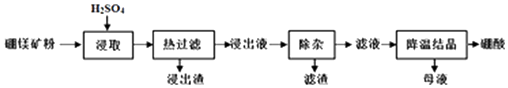
已知:i.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4.
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.
(1)为了提高硼镁矿粉的浸出率,可采取的措施有(至少答两条).
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42﹣ , 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,H2O2的作用是(用离子方程式表示),MgO除去的杂质离子是 .
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式 .
(4)“浸取”后,采用“热过滤”的目的是 , 母液中的主要溶质有 .
(5)测定所得产品的纯度:取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,则产品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铁粉反应放出大量氢气,此溶液中可能大量共存的离子组是( )
A.H+、K+、Mg2+、Cl﹣
B.Ba2+、SO ![]() 、Cl﹣、OH﹣
、Cl﹣、OH﹣
C.K+、OH﹣、CO ![]() 、MnO
、MnO ![]() ?
?
D.Ca2+、H+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10molL﹣1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现象 | 无气体 | 产生气体 | 无气体 |
请回答下列问题:
(1)配制0.10molL﹣1的稀盐酸250mL,需要10.0molL﹣1的浓盐酸的体积为mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com