
(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应:
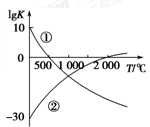
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+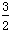 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
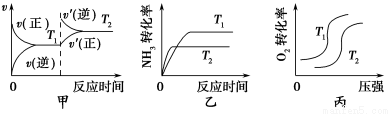
②该燃料电池的负极反应式是____________________________________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。
(本小题14分,每空2分)(1) d;(2)阴极;4OH--4e-=2H2O+O2↑ 或2H2O-4e-=O2↑+4H+
(3)+765.0 (4) ①乙 ② 2NH3-6e-+6OH-=== N2↑+6H2O
(5)由工业合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol可知该反应的正反应为放热反应,温度过高时,导致平衡逆向移动,因而氨气的产率降低。
2NH3(g) ΔH=-92.4 kJ/mol可知该反应的正反应为放热反应,温度过高时,导致平衡逆向移动,因而氨气的产率降低。
【解析】
试题分析:根据图像①可知温度越高,平衡常数越小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,则该反应的正反应是放热反应;②温度越高,平衡常数越大,说明升高温度,平衡正向移动,正反应方向是吸热反应;所以选项A错误;B.常温下,由于N≡N的键能和H—H、O=O的键能都很大,所以反应①②的反应速率不大,错误;C.升高温度,无论是放热反应还是吸热反应,反应速率都增大,错误;D.在常温下,根据平衡常数可知:利用反应①固氮和利用反应②固氮反应程度相差很大,正确。(2)根据反应方程式可知:在反应中N2得到电子,作氧化剂,因此应该作阴极,在阳极则是OH-失去电子被氧化,电极反应式是4OH--4e-=2H2O+O2↑ 或2H2O-4e-=O2↑+4H+;(3) (②—①)×2÷3,整理可得,2H2(g)+O2(g) 2H2O(l) ΔH=-(92.4+a) ×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-=== N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。
2H2O(l) ΔH=-(92.4+a) ×2÷3=—571.6 kJ/mol,则a=+765.0KJ/mol;(4) ①升高温度,正反应、逆反应的化学反应速率都加快,达到平衡所需要的时间缩短。所以甲错误;由于该反应的正反应是放热反应。根据平衡移动原理可知:升高温度,平衡逆向移动,达到平衡时NH3的转化率降低,乙错误;该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的逆反应方向移动,所以O2的转化率降低,错误。②该燃料电池的负极发生氧化反应,根据方程式可知NH3在反应中元素的化合价升高,失去电子,被氧化,因此在负极的电极反应式是2NH3-6e-+6OH-=== N2↑+6H2O;(5)工业上合成氨时,温度过高,氨气的产率降低,这是由于合成氨的正反应是放热反应,升高温度,平衡向吸热反应方向移动,对该反应来说,平衡逆向移动,所以合成氨时,温度过高,氨气的产率降低。
考点:考查热化学方程式的书写、温度对平衡的影响、原电池 原理的应用、反应条件的选择与物质产率的关系的知识。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列分类依据和结论都正确的是
A.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸
B.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s 内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.达平衡时,N2O5的转化率为50%
C.达平衡后,升高温度平衡常数减小
D.达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列化学用语不能正确表示相应粒子的是
A.HClO的电子式:
B.C2H6的结构简式:CH3CH3
C.CO2的结构式:O=C=O
D.O2-的结构示意图:
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中,正确的是
A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA
B.7g CnH2n中含氢原子数为NA
C.78 g 过氧化钠与CO2反应,转移电子数为2NA
D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
下列图示与对应的叙述一定正确的是
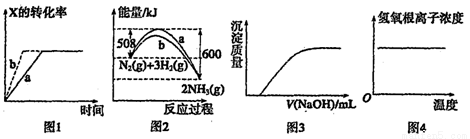
A.图1所示反应:X(g)+Y(g) 2Z(g),b的压强一定比a大
2Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化
D.图4表示明矾溶液受热时氢氧根浓度随温度的变化
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
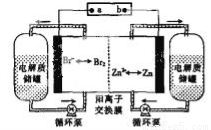
A.充电时电极a为电源的负极
B.放电时负极的电极反应式为 Zn+2e-=Zn2+
C.放电时左侧的电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止 Br2和Zn 直接发生反应
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
A.元素Y、P的简单氢化物中化学键类型相同
B.原子半径:X>Y
C.最高价氧化物的水化物酸性:P<Q
D.X、Q两元素的最高正化合价相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com