
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.③⑥ | C.①④ | D.⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO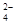 )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
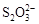

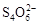 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

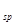 (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K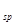 (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25 ℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1 |
| C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP/250C | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI) |
| D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com