
分析 短周期元素中,Na的金属性最强,F的非金属性最强,电子层数相同时,核电荷数越少半径越大,元素最高价氧化物中既能与盐酸反应又能与烧碱反应,是两性氢氧化物氢氧化铝,以此来解答.
解答 解:短周期元素中,①Na的金属性最强,②F的非金属性最强,则与水反应最剧烈的非金属单质是F2,③在11~18号的元素中,原子半径最小的元素是Cl,元素最高价氧化物中既能与盐酸反应又能与烧碱反应,是两性氢氧化物氢氧化铝,所以对应的元素的氧化物是Al2O3,故答案为:①Na;②F2;③Cl; ④Al2O3.
点评 本题考查元素周期表及元素周期律,为高频考点,把握元素的位置、金属性和非金属性的比较为解答的关键,注意短周期、第三周期元素的性质,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | Mg2+、Na+、NO3-、Cl- | B. | K+、Ba2+、MnO4-、NO3- | ||
| C. | Na+、K+、CO32-、Cl- | D. | Ba2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
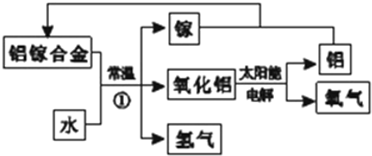 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
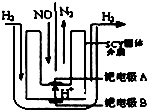 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H5CH2CH=M | B. | CH2=CH2 | ||
| C. | C6H5CH2CH2C6H5 | D. | C6H5CH2CH=CHCH2C6H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
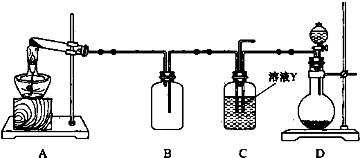
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com