
| A. | 可以利用铝热反应冶炼高熔点的金属 | |
| B. | 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100% | |
| C. | 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可 | |
| D. | 煤直接液化可得液体燃料 |
分析 A、铝热反应可应用于焊接钢轨,还应用于冶炼高熔点金属如钒、铬、锰等;
B、乙烯在银作催化剂条件下被氧气氧化生成环氧乙烷;
C、向酸化的浓缩海水中直接通入氯气置换出的溴浓度很低;
D、煤直接液化可以制得甲醇.
解答 解:A、利用铝热反应可以冶炼熔点较高的金属如钒、铬、锰等,故A正确;
B、乙烯在银作催化剂条件下被氧气氧化生成环氧乙烷,反应的方程式为:2CH2═CH2+O2 $\stackrel{银}{→}$2 ,原子利用率达100%,故B正确;
,原子利用率达100%,故B正确;
C、工业上制取溴要先将浓缩海水中的溴用氯气置换出,然后将溴吹入二氧化硫吸收塔中富集,然后再通入氯气置换出,故C错误;
D、煤直接液化可以制得甲醇,是一种液体燃料,故D正确.
故选C.
点评 本题考查了煤和石油的综合利用和铝热反应的用途等,难度不大,应注意原子利用率的判断.


科目:高中化学 来源: 题型:选择题
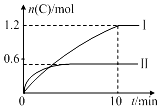 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )| 实验序号 | 温度 | 起始物质的量 | 热量变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5 mol | -- |
| A. | a=160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
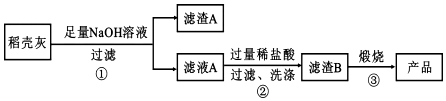
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有少量KSCN的FeI2溶液中滴加少量溴水,溶液出现血红色 | |
| B. | 用NH4HCO3固体以及其他固体药品能制得纯净的NH3 | |
| C. | 将SO2通入酸性KMnO4溶液中,溶液褪色,体现了SO2的漂白性 | |
| D. | 加热条件下,过量的Fe与浓硫酸反应只生成SO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol纯物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 放热反应热化学方程式中△H就是该反应物的燃烧热 | |
| C. | 物质的燃烧热可利用仪器由实验测得 | |
| D. | 物质燃烧必然伴随发光发热现象且肯定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①④ | C. | ③⑤ | D. | ②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com