
【题目】下列反应的离子方程式正确的是
A.向Ca(ClO)2溶液中通入过量CO2制次氯酸:2ClO + H2O + CO2=2HClO +![]()
B.[Ag(NH3)2]OH与较浓盐酸反应生成AgCl:[Ag(NH3)2]+ + OH + 3H+ + Cl=AgCl↓+2![]() + H2O
+ H2O
C.Cl2与热的NaOH溶液反应制取NaClO3:2Cl2 + 6OH![]() 3Cl +
3Cl +![]() + 3H2O
+ 3H2O
D.向酸性KMnO4溶液中通入SO2:2![]() + 5SO2 + 4OH=2Mn2+ + 5
+ 5SO2 + 4OH=2Mn2+ + 5![]() + 2H2O
+ 2H2O
【答案】B
【解析】
A.Ca(ClO)2溶液中通入过量CO2时,生成次氯酸和Ca(HCO3)2,正确的离子方程式为:ClO-+H2O+CO2=HClO+![]() ,A选项错误;
,A选项错误;
B.[Ag(NH3)2]OH与足量盐酸反应生成AgCl,该反应的离子方程式为:[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O,B选项正确;
C.Cl2与热的NaOH溶液发生氧化还原反应生成NaClO3,正确的离子方程式为:3Cl2+6OH-![]() 5Cl-+
5Cl-+![]() +3H2O,题中所给的离子方程式电荷不守恒,C选项错误;
+3H2O,题中所给的离子方程式电荷不守恒,C选项错误;
D.向酸性KMnO4溶液中通入SO2,二者发生氧化还原反应,正确的离子方程式为:5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+,D选项错误;
+2Mn2++4H+,D选项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室经常用KMnO4与过量浓盐酸反应制备氯气,化学方程式如下:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)用单线桥标出电子转移的方向和数目:__________。
(2)将此反应改写为离子方程式:___________________。
(3)若31.6g KMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为_____,在标准状况下生成的Cl 2的体积为____。
(4)用生成的氯气通入下面的装置来验证氯气的某些性质。
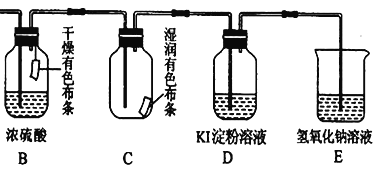
用离子方程式解释C中有色布条褪色的原因:______________,将B、C的顺序颠倒,可否达到原来的实验目的:______(填“可以”或“不可以”);D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2 、KMnO4 的氧化性,由强到弱为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1NA
C.1 L 0.5 mol·L-1醋酸钠溶液中阴、阳离子总数目大于NA
D.0.1 mol环氧乙烷(![]() )中含有共价键的总数约为0.3×6.02×1023
)中含有共价键的总数约为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为_______。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行______。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是___,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为_____(填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)解释CO比N2的熔沸点高的原因___。
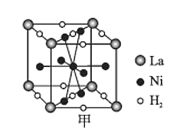
(6)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为___。
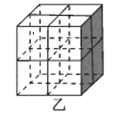
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___(填“八面体空隙”或“四面体空隙”)。若晶体的密度为d g/cm3,Mg2NiH4的摩尔质量为M g/mol,则Mg2+和Ni原子的最短距离为___nm(用含d、M、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学工厂产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等离子。综合利用该酸洗废液的工艺流程如下:

已知:①Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
②金属离子开始沉淀和沉淀完全时的pH表③Ksp(CaF2)=4![]() 10-11
10-11
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
回答下列问题:
(1)再生酸中主要含有硝酸,采取减压蒸馏的原因是_______________________
(2)渣1的主要成份为______(填化学式)
(3)转化时发生反应的离子方程式______________________________
(4)用平衡移动的原理解释沉镍的原理_____________________________
(5)渣3的主要成分为氢氧化钙和_______________ 、_________________(填化学式)
(6)国家排放标准要求c(F-)≤3.8 mgL-1。残液中残留的Ca2+浓度至少应为_____mgL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O①
2NO2+2NaOH===NaNO2+NaNO3+H2O②
在反应①中,氧化剂是________________,还原剂是________________,在反应②中,氧化剂和还原剂的物质的量之比为___________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为____________________________。
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)________,原因是________________________________________________________________________。
(4)目前有一种治理方法是在一定条件下,用氨气将氮氧化物转化为无污染的物质,请写出该反应的化学方程式:________________________________________________,该反应中,氧化剂是________,氧化产物是________,生成1.4 mol氮气时,转移电子的物质的量为_______________________________________________。
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3 L,通入3 L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。

反应①使杂质生成氟化物的沉淀,对反应①前后的杂质含量检测结果(以350g/LMnSO4计)如下:
杂质 | 净化前/g | 净化后/g | 去除率/% |
Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)滤渣x中含有的物质是_____。
(2)试分析钙镁去除结果不同的原因:_____。
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+.该反应的离子方程式为_____。
(4)已知:生成氢氧化物沉淀的pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 6.3 | 1.5 | 8.3 |
完全沉淀时 | 8.3 | 2.8 | 9.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释流程中②的目的:_____。
(5)进一步研究表明,如果反应①后不过滤直接加入KMnO4,同时控制加入的量,反应后调节pH,然后再过滤,可以进一步提高钙镁的去除率.钙镁去除率提高的原因有如下假设:
假设I:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设II:Mn2+与反应生成的活性MnO2吸附了沉淀物。
选择适当的无机试剂,设计实验验证假设是否成立____________________。
(6)锂离子电池充放电过程中,锂离子在正极和负极之间来回移动,就像一把摇椅,称“摇椅式电池”。典型的锂离子电池工作原理如图所示。

①放电时Li+的移动方向从__________极到极_____(填“a”或“b”)。
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
平昌冬奥会闭幕式上,“2022,相约北京”文艺表演蕴含了丰富的中国文化,展现了新时代中国形象。


熊猫木偶:熊猫木偶高2.35m,质量仅为10kg,用铝合金管材和碳纤维条做框架,配合LED灯制作而成。其中,碳纤维是含碳量高于90%的新型材料,密度比铝小,强度比钢大。
智能机器人:中国新一代智能机器人与轮滑舞者共舞、互动,在导航精准性、动作复杂性和灵活性等方面,实现了人工智能领域的升级创新。
石墨烯智能发热服:这种智能发热服可在20℃的条件下持续发热4h。石墨烯是一种由碳原子构成的六角型二维碳纳米材料,具有超高硬度、强度和导热系数等特性。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)熊猫木偶、智能机器人、石墨烯智能发热服展现了“中国智慧”。_____。
(2)碳纤维具有优良的性能,将有广泛的应用前景。_____。
(3)中国新一代智能机器人在动作、导航等方面实现了人工智能领域的升级创新。_____。
(4)石墨烯和石墨由同种元素组成,但它们的物理性质差异较大。_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com