
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )


A.②①③④⑤⑥ B.⑤④②①③⑥
C.⑤④③①②⑥ D.⑤③②④①⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题18烃及其有机物的命名练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.(CH3)2C CHCH2CH3中所有碳原子共面
CHCH2CH3中所有碳原子共面
B.苯不能使酸性高锰酸钾溶液褪色,证明苯分子中不存在单双键交替的结构
C.聚乙烯能使溴水褪色
D.甲醇、乙二醇(HOCH2CH2OH)互为同系物
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图所示,下列说法正确的是( )
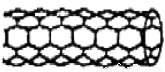
A.纳米碳管是一种无机化合物
B.纳米碳管中碳原子间以共价键结合
C.纳米碳管与石墨互为同位素
D.0.12 g纳米碳管中含有6.02×l022个碳原子
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:填空题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C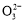 、HC
、HC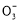 、Al
、Al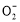 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是( )
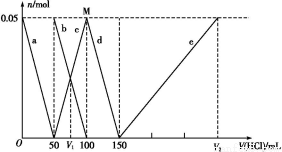
A.原混合溶液中的C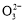 与Al
与Al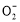 的物质的量之比为1∶2
的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.a线表示的离子方程式为:Al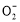 +H++H2O
+H++H2O Al(OH)3↓
Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:填空题
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: 。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH-
C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体为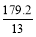 L
L
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下表是五种银盐的溶度积常数(25 ℃):
化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
下列关于电化学知识说法正确的是( )
A.电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Cu、Fe、Al
B.电解CuSO4溶液一段时间后,加入适量Cu(OH)2可以使溶液恢复至原状态
C.铅蓄电池在充电时,连接电源正极发生的电极反应为PbSO4+2e-=Pb+SO42-
D.将钢闸门与直流电流的负极相连,可防止钢闸门腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷B(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1

测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com