
| A. | 加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 | |
| C. | 某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- | |
| D. | 未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
分析 A.铜和硝酸银溶液发生置换反应生成硝酸铜和Ag;
B.二氧化碳和HCl都和NaOH反应;
C.能和氯化钡溶液反应生成白色沉淀的离子有硫酸根离子、亚硫酸根离子、银离子等;
D.能和稀盐酸反应生成使澄清石灰水变浑浊的气体的离子有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子.
解答 解:A.铜和硝酸银溶液发生置换反应生成硝酸铜和Ag,然后采用过滤方法除去Cu、Ag,故A正确;
B.二氧化碳和HCl都和NaOH反应,应该用饱和的碳酸氢钠溶液除去二氧化碳中的HCl,故B错误;
C.能和氯化钡溶液反应生成白色沉淀的离子有硫酸根离子、亚硫酸根离子、银离子等,所以该溶液中不一定含有硫酸根离子,故C错误;
D.能和稀盐酸反应生成使澄清石灰水变浑浊的气体的离子有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,所以该溶液中不一定含有碳酸根离子,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、离子检验等知识点,明确物质性质及除杂方法是解本题关键,注意:除杂时要除去杂质且不能引进新的杂质,离子检验时要排除其它离子干扰.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | O2、S、Br2 | B. | CH4、SiH4、GeH4 | C. | Li、Na、K | D. | H2O、H2S、H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
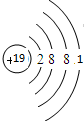 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,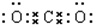 .
.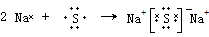 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
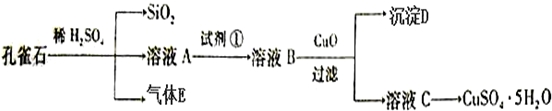
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
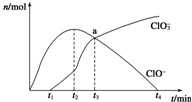 工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:
工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 氢氧燃料电池正极消耗 22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 | |
| D. | 10LpH=13的NaOH溶液中含有的OH-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的N2和CO2 | B. | 同质量的H2和N2 | ||
| C. | 同体积的O2和N2 | D. | 相同物质的量的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com