
| A. | 重结晶纯化法 | B. | 萃取纯化法 | C. | 吸附纯化法 | D. | 蒸馏纯化法 |
科目:高中化学 来源: 题型:选择题
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 电极反应式 | 出现的环境 |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | Cu-2e-═Cu2+ | 用铜做电极电解NaOH溶液的阳极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
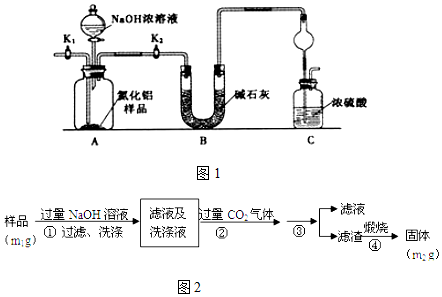
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
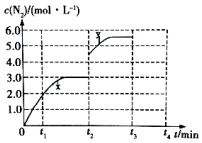 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
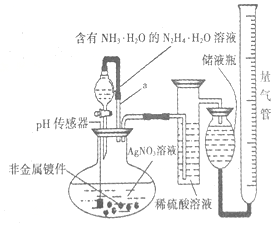 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):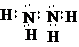 .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:④>③>②>① | B. | 原子半径:④>③>②>① | ||
| C. | 第一电离能:④>③>②>① | D. | 最高正化合价:④>③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com