
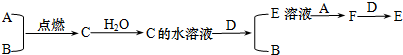
分析 A、B为气体单质,二者反应得到C,C的水溶液与D反应得到E与B,考虑是金属与酸的反应,B为H2,B能与气体A反应生成F,而F又能与D反应得到E,则D为变价金属,A具有强氧化性,则A为Cl2,D为Fe,C为HCl,E为FeCl2,F为FeCl3,据此解答.
解答 解:A、B为气体单质,二者反应得到C,C的水溶液与D反应得到E与B,考虑是金属与酸的反应,B为H2,B能与气体A反应生成F,而F又能与D反应得到E,则D为变价金属,A具有强氧化性,则A为Cl2,D为Fe,C为HCl,E为FeCl2,F为FeCl3.
(1)由上述分析可知,A为Cl2,B为 H2,C为HCl,D为Fe,
故答案为:Cl2; H2;HCl;Fe;
(2)E的水溶液与A反应的化学反应方程式:2FeCl2+Cl2═2FeCl3,
F+D反应的离子方程式:Fe+2Fe3+═3Fe2+,
故答案为:2FeCl2+Cl2═2FeCl3;Fe+2Fe3+═3Fe2+;
(3)检验FeCl3中阳离子的试剂可以用:KSCN溶液,现象是:溶液变为血红色,
故答案为:KSCN溶液;溶液变为血红色;
(4)E+NaOH的现象:先出现白色絮状沉淀,迅速变为灰绿色,最终变为红褐色,相应的化学方程式为:FeCl2+2NaOH═Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:先出现白色絮状沉淀,迅速变为灰绿色,最终变为红褐色;FeCl2+2NaOH═Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查无机物的推断,需要学生熟练掌握元素化合物性质,基本属于猜测验证型题目,根据转化关系判断A、D的性质等,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
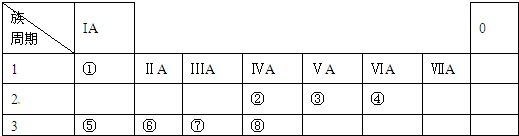
| A. | ⑤⑧ | B. | ⑤⑥⑦⑧ | C. | 均不可 | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com