
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2?2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故A不选;
B.催化剂能增大化学反应速率,但不引起平衡移动,所以不能用平衡移动原理解释,故B选;
C.该反应是可逆反应,让K成蒸汽从反应混合物中分离出来,减小生成物的浓度能上平衡正向移动,能用勒夏特列原理解释,故A不选;
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用,故D不选;
故选B.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
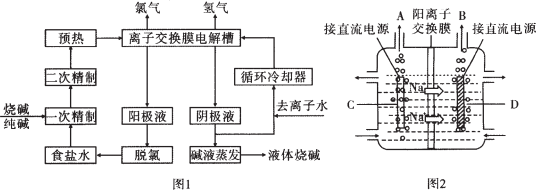
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
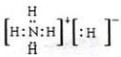 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ③④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 亚硝酸钠外观与食盐相似,误食会引起中毒,因此不能用作食品添加剂 | |
| C. | 取试管向其加入适量CoCl2的盐酸溶液,将溶液进行稀释,可以观察到溶液颜色由粉红色变为蓝色 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
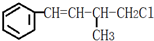 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下能发生消去反应和取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com