
【题目】下列各组物质能用分液漏斗分离的是( )
A. 溴和苯 B. 溴和溴苯 C. 水和乙醇 D. 水和硝基苯
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B,D起始浓度为0,反应物A的的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B,D起始浓度为0,反应物A的的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_________mol/(L·min)。
(2)在实验2,A的初始浓度c2=_________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是____________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______________v1(填>、=、<),且c3___________1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应速率快的是________,理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出的是一些物质的燃烧热数据:
物质 | ΔH/kJ·mol-1 | 物质 | ΔH/kJ·mol-1 |
C(s) | -393.5 | C2H6(g) | -1 559.8 |
H2(g) | -285.8 | C3H8(g) | -2 219.9 |
C2H4(g) | -1 411.0 | C12H26(l) | -8 162.0 |
(1)分析上表数据可知:
①分别完全燃烧C(s)和C3H8(g)提供相同的热量,其中 产生的温室气体更多。
②不同烃燃烧的热值(单位质量完全燃烧所放出的热量多少)与元素含量之间的关系是 。
(2)根据上表的数据 (填“能”或“不能”)计算出反应C2H4(g)+H2(g)===C2H6(g)的焓变,若能,请你求出该反应的焓变为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。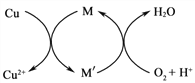
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O
S4O![]()
(1)写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________________。
(2)取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧量,消耗0.010 00 mol·L-1Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为___________ mg·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 ρ=1.73 g·cm-3 的液态 TiCl4 配制 100 mL 3.55 mol·L-1 ( ρ=1.42 g·cm-3)的TiCl4溶液, 下列说法不正确的是
A. 所配溶液的质量分数为 47.5% B. 应量取 38.99 mL TiCl4液体
C. 可以选用一定浓度的盐酸溶解TiCl4 D. 定容时俯视刻度线会导致所配溶液浓度偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com