
下列叙述中正确的是( )
A.NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂
B.工业上制H2SO4过程中SO2氧化条件一般选择高温、高压、催化剂
C.浓H2SO4有强氧化性,常温下能与Cu发生反应
D.将C12通入冷的消石灰中可制得漂白粉
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)实验室制取乙炔的化学方程式为 ;实验产生的气体中有一种有很难闻的气味,常用某蓝色溶液除去该气体,产生黑色沉淀,写出该过程的离子反应方程式:
。
(2)已知炔烃具有一定的酸性,可以与活泼金属,如钠或氨基钠反应,生成炔负离子。
CHCH+NaNH2―→CHCNa+NH3
炔负离子可以与卤代烃发生如下反应:
R′C≡CNa+R-X―→R′C≡CR+NaX(R为烃基,X为卤原子)
根据所提供的信息,以乙炔为原料(无机试剂任选),设计最简单的方案合成1,1,2,2,3,4-六氯丁烷(用化学方程式表示,反应条件可不写):
查看答案和解析>>
科目:高中化学 来源: 题型:
材料与化学密切相关,表中对应关系不正确的是 ( )
|
| 材料 | 主要化学成分 |
| A. | 水泥 | 硅酸盐 |
| B. | 光导纤维 | 晶体硅 |
| C. | 碳素钢 | 铁碳合金 |
| D. | 沙子 | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
(已知氧化性:Fe3+>Cu2+)( )
A. 溶液中一定含Cu2+ B. 溶液中一定含有Fe2+
C. 加入KSCN溶液一定不变红色 D. 剩余固体中一定含铜
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式______________________
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式_____________________________________________
⑶洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
______________________________________________________
⑷ 在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是________,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的______________

⑸硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,当有0.5molCuSO4参加反应时转移电子数为3.01×1023,写出符合此反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
 A.a 为电源的正极
A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH——4e-==2H2O+O2↑
D.电解饱和食盐水的总反应是:2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.配制FeCl3溶液,可将一定量FeCl3固体溶于适量盐酸中并加入少量铁粉
B.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
C.配制0.1 mol·L-1 NaOH溶液100 mL,将4.0 g NaOH固体放入100 mL容量瓶中溶解
D.向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A. 连接全部仪器,使其成为如图装置,并检查装置的气密性。
B. 称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D. 以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
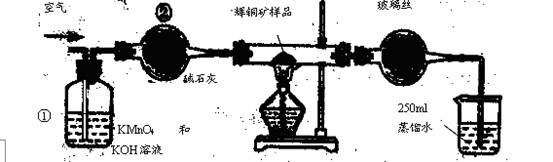
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生______________________________ _的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是
(写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com