考点:酸、碱、盐、氧化物的概念及其相互联系,化学基本反应类型
专题:物质的分类专题
分析:(1)①电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
氧化物:氧元素与另外一种化学元素组成的二元化合物;
②置换反应:指一种单质和一种化合物生成另一种单质和另一种化合物的反应;
分解反应:指一种化合物分解成二种或二种以上较简单的单质或化合物的反应;
化合反应:指的是由两种或两种以上的物质生成一种新物质的反应;
复分解反应:是由两种化合物互相交换成分,生成另外两种化合物的反应;
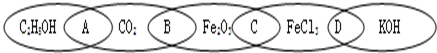
③C
2H
5OH、CO
2与强酸不反应;Fe
2O
3与盐酸反应生成氯化铁和水;FeCl
3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
④根据氢氧化铁胶体的制备方法和胶体的性质进行判断.
(2)①根据酸性氧化物与碱反应生成盐和水生成反应的化学方程式;
②NaHSO
3与氯化氢反应生成氯化钠和二氧化硫和水、NaHSO
3与氢氧化钠反应生成亚硫酸钠和水,据此写出反应的化学方程式.
(3)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
乙
甲,为FeCl
3FeCL
2FeCL
3;
①甲到乙是氯化铁和铁反应生成氯化亚铁;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁.
解答:
解:(1)①CH
3CH
2OH不是氧化物;在水中和熔化状态下都不能导电,属于非电解质,
二氧化碳是氧化物;在水溶液中与水反应生成碳酸,二氧化碳自身不能电离,是非电解质,
Fe
2O
3是氧化物;在熔融状态下能够导电,属于电解质,
FeCl
3不是氧化物;在水溶液中能够导电,属于电解质,
KOH不是氧化物;在水溶液中能够导电,属于电解质,
故相连的两种物质都是电解质的是CD;都是氧化物的是B;
故答案为:CD;B;
②C
2H
5OH与CO
2不能反应;CO
2与Fe
2O
3不能反应;Fe
2O
3与FeCl
3不能反应;
FeCl
3与KOH能够发生反应,生成氢氧化铁沉淀和氯化钾,属于复分解反应;
故答案为:D;复分解;
③C
2H
5OH、CO
2与强酸不反应;Fe
2O
3与盐酸反应生成氯化铁和水;FeCl
3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
故符合条件的反应为Fe
2O
3与盐酸反应生成氯化铁和水,离子方程式为:Fe
2O
3+6H
+=2Fe
3++3H
2O;
故答案为:Fe
2O
3+6H
+=2Fe
3++3H
2O;
④用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为胶体,要证明胶体的实验的方法是丁达尔效应,
故答案为:胶体;丁达尔效应.
(2)①SO
3与NaOH反应生成了硫酸钠和水,反应的化学方程式为:SO
3+2NaOH=Na
2SO
4+H
2O,
故答案为:SO
3+2NaOH=Na
2SO
4+H
2O;
②NaHSO
3分别与HCl反应生成氯化钠和二氧化硫气体和水,反应的化学方程式为:NaHSO
3+HCl=NaCl+H
2O+SO
2↑; NaHSO
3与NaOH反应生成亚硫酸钠与水,反应的方程式为:NaHSO
3+NaOH=Na
2SO
3+H
2O,
故答案为:NaHSO
3+HCl=NaCl+H
2O+SO
2↑;NaHSO
3+NaOH=Na
2SO
3+H
2O.
(3)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
乙
甲,为FeCl
3FeCL
2FeCL
3,故答案为:FeCl
3;
①甲到乙是氯化铁和铁反应生成氯化亚铁,化学方程式为:2FeCl
3+Fe=3FeCl
2;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe
2++Cl
2=2Fe
3++2Cl
-;
故答案为:2FeCl
3+Fe=3FeCl
2;Cl
2;2Fe
2++Cl
2=2Fe
3++2Cl
-;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁,反应的离子方程式为:2Fe
3++Cu=2Fe
2++Cu
2+,故答案为:2Fe
3++Cu=2Fe
2++Cu
2+.
点评:本题考查电解质和非电解质、氧化物概念的辨析、四种基本反应类型的判断、离子方程式的书写、胶体的制备及性质等知识,难度中等.要注意基础知识的积累.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案