
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是________,基态D原子价电子的轨道表达式为________________。
(2)DA2分子的VSEPR模型是____________。
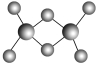
(3)实验测得C与氯元素形成的化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于________(填晶体类型)晶体,其中C原子的杂化轨道类型为________杂化。
②[C(OH)4]-中存在的化学键有____________________________________________。
(4)单质A有两种同素异形体,其中沸点高的是__________ (填分子式),原因是______________________________________________________________
(5)D与E所形成化合物晶体的晶胞如图所示 。
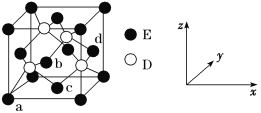
①在该晶胞中,E的配位数为________。
②原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2);c为(1/2,1/2,0)。则d的坐标参数为________。
【答案】镁(或Mg) ![]() 平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) O3 O3的相对分子质量大,分子间作用力也大,沸点也高 4 (1,1/2,1/2)
平面三角形 分子 sp3 极性共价键、配位键(或共价键、配位键) O3 O3的相对分子质量大,分子间作用力也大,沸点也高 4 (1,1/2,1/2)
【解析】
A、D为同主族且有两种常见化合物DA2和DA3,则A是O,D是S;工业上常电解熔融的C2O3来制取C,故C为Al;B在A、D之间且最外层只有两个电子,故B是Mg;由E位于元素周期表中ds区,E的最外层有两个电子且其余各层全充满,原子序数大于S,位于第四周期,则E是Zn。
综上,A、B、C、D、E分别为O、Mg、Al、S、Zn。
(1)Mg的最外层电子排布为3s2,而Al为3s23p1,Mg的3s能级全充满,较稳定,故Mg的第一电离能大于Al;D为S,其价电子排布式为3s23p4,结合泡利原理和洪特规则,可写出硫原子价电子轨道表达式为![]() ,
,
故答案为:镁(或Mg);![]() ;
;
(2)DA2为SO2,中心原子硫的价层电子对数为![]() =3,则其VSEPR模型为平面三角形,故答案为:平面三角形;
=3,则其VSEPR模型为平面三角形,故答案为:平面三角形;
(3)①C2Cl6为Al2Cl6,加热易升华可知其沸点较低,推测其为分子晶体;由球棍模型图可知铝原子的价层电子对数为4,则Al为sp3杂化;
②[Al(OH)4]-中,氢、氧原子之间形成O-H极性共价键,三个O与Al的三个电子形成Al-O极性共价键,此外,一个OH-中氧原子提供孤对电子,Al提供空轨道,形成O→Al配位键,
故答案为:分子;sp3;极性共价键、配位键;
(4)氧元素有O2和O3两种单质,其中O3的相对分子质量大,分子间作用力也大,沸点也高,
故答案为:O3;O3的相对分子质量大,分子间作用力也大,沸点也高;
(5)①在该晶胞中,与E相距最近的D原子个数为4,则E的配位数为4;
②该坐标系是以a为坐标原点的坐标系,根据b、c的坐标可得d原子的坐标为(1,![]() ,
,![]() );
);
故答案为:4;(1,![]() ,
,![]() )。
)。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
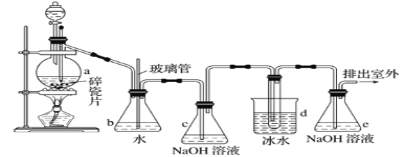
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____(填“<”或“>”)NiO。
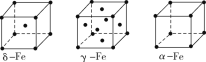
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__;该晶体中,原子之间的相互作用是____。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
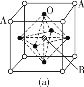
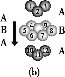
①用A、B、O表示这类特殊晶体的化学式:____。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____。
③下列有关说法正确的是____。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了Cu—Ni—Zn—Sn—Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)
(2)基态Ni2+的核外电子排布式为________;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO______FeO(填“<”或“>”),其原因是_________________________________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol (SCN)2分子中含有σ键的数目为________;写出一种与SCN-互为等电子体的分子________(用化学式表示)。
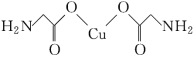
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。
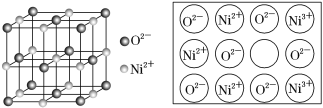
(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为a pm,列式表示NiO晶体的密度为________g·cm-3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.100g质量分数为17%的H2O2水溶液中含氧原子数目为NA
B.0.1molH2(g)与0.1molI2(g)于密闭容器中充分反应生成HI(g)后,其分子总数小于0.2NA
C.8.0gCH4与足量Cl2在光照下反应生成的HCl分子数最多为2NA
D.标准状况下,将54g铝片投入足量冷的浓硝酸中生成134.4LNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
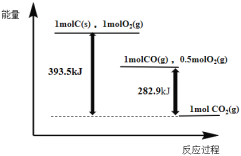
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O)
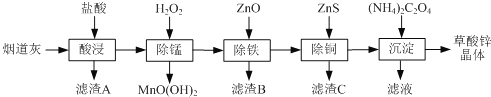
已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________、________(填写2条)。
(2)“除锰”反应后,溶液的pH__________(填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________。
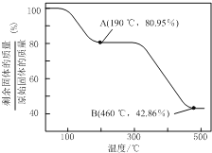
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
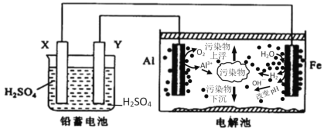
A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com