

| a×1000 |
| 22.4 |
| 3 |
| x |
| 87×5 |
| 1000c |
| 3000c |
| 435 |
| 3000c |
| 435 |
| 3000c |
| 435 |
| 1500c-87ab |
| 2500 |
| 1500c-87ab |
| 2500 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、S(s)的能量高于SO2(g)的能量 |
| B、S(s)和O2(g)的总能量大于SO2(g)的能量 |
| C、若有S(g)+O2(g)=SO2(g)△H2,则△H2>△H1 |
| D、形成1mol SO2(g)的化学键释放的总能量比断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量多297.23kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s ) |
| B、v(C)=6.0mol/(L?min) |
| C、v(B)=0.6mol/(L?s) |
| D、v(D)=0.4mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(CH3)3CH2OH |
| B、CH(CH3)2CHOHCH3 |
| C、CH3CH2CHOHCH3 |
| D、CH3CH2CHOHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2006年诺贝尔化学奖、医学和生理学奖分别授予在研究DNA、RNA方面有突出成就的美国科学家.核酸有两种:含核糖的是核糖核酸(RNA),含脱氧核糖的是脱氧核糖核酸(DNA),人们的基因组通过从细胞核里的DNA向蛋白质的合成机制发出生产蛋白质的指令运作,这些指令通过mRNA传送.核糖是合成核酸的重要原料,常见的两种核糖结构简式为:戊醛糖CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述不正确的是( )
2006年诺贝尔化学奖、医学和生理学奖分别授予在研究DNA、RNA方面有突出成就的美国科学家.核酸有两种:含核糖的是核糖核酸(RNA),含脱氧核糖的是脱氧核糖核酸(DNA),人们的基因组通过从细胞核里的DNA向蛋白质的合成机制发出生产蛋白质的指令运作,这些指令通过mRNA传送.核糖是合成核酸的重要原料,常见的两种核糖结构简式为:戊醛糖CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述不正确的是( )| A、戊醛糖和D-核糖互为同分异构体 |
| B、它们都能发生酯化反应 |
| C、戊醛糖属于单糖 |
| D、由戊醛糖→脱氧核糖(CH2OH-CHOH-CHOH-CH2-CHO)可看成是一个氧化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
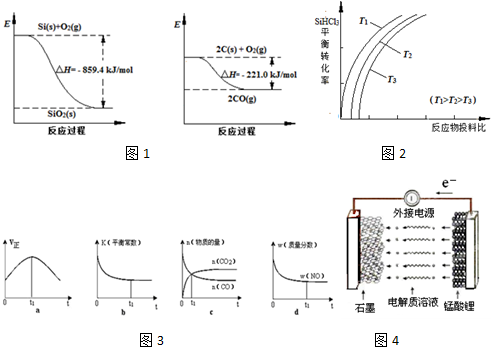
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
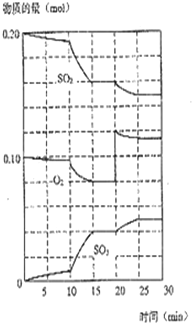 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应:| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用结晶的方法除去氯化钠溶液中的泥沙 |
| B、用酒精萃取溴水中的溴单质 |
| C、用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) |
| D、用过滤的方法从含有少量氯化钠溶液的硝酸钾溶液中提取硝酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com