
| A. | 氧化铝的熔点很低,不能用于制作耐高温材料 | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 无水乙醇用作医用消毒剂效果更好 | |
| D. | Na、S、C分别在氧气中点燃均可得到两种不同的氧化物 |
分析 A.根据氧化铝的熔点很高,可作耐火材料;
B.含氮氧化物、一氧化碳、碳氢化合物等废气在强烈的日光作用下,这些排放物发生光化反应,生成二次污染物,这是一种浅蓝色、有刺激性的烟雾--光化学烟雾;
C.75%乙醇用作消毒是用75%乙醇;
D.S在氧气中点燃只能生成二氧化硫.
解答 解:A.氧化铝的熔点很高,则能用于制作耐高温材料,故A错误;
B.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关,故B正确;
C.用作消毒是用75%乙醇,故C错误;
D.S在氧气中点燃只能生成二氧化硫,Na、C分别在氧气中点燃均可能得到两种不同的氧化物,故D错误;
故选:B.
点评 本题主要考查了物质的性质与用途,难度不大,注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
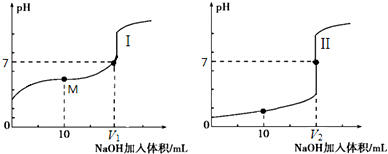
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ⅰ | A、B、C、D、E、F、G七种短周期元素的原子序数依次增大 |
| Ⅱ | A和E同主族,B和F同主族,D和G同主族 |
| Ⅲ | A原子核内只有质子没有中子,B原子最外层电子数是电子层数的2倍 |
| Ⅳ | D和F以原子个数比为2:1组成的物质X是光导纤维的主要成分 |
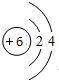 ,物质X的化学式为SiO2
,物质X的化学式为SiO2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与HCN均为弱酸 | |
| B. | 常温下,等浓度CH3COONa溶液的pH小于NaCN溶液的pH | |
| C. | 在CH3COONa溶液中,c(Na+)+c(H+)═c(CH3COO-)+c(CH3COOH) | |
| D. | 在NaCN溶液中,c(Na+)>c(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

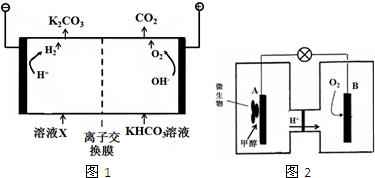
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提纯胶体可采用渗析的方法 | |
| B. | 用丁达尔效应可以区别溶液和胶体 | |
| C. | 往氯化铁溶液中滴加少量氢氧化钠溶液可制得氢氧化铁胶体 | |
| D. | 加热可使胶体发生聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com