
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、K与水反应最剧烈 |
| B、Rb比Na活泼,故Rb可以从Na的盐溶液中置换出Na |
| C、碱金属的阳离子没有还原性,所以有强氧化性 |
| D、从Li到Cs都易失去最外层一个电子,且失电子能力逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
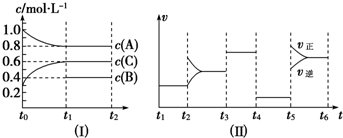
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
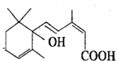 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,回答:
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:D>C>B>A |
| B、C与B只能形成一种化合物 |
| C、A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
| D、C和E的单质可通过电解饱和的CE水溶液获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa) |
| B、已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol?L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-1 |
| C、25℃时,0.1mol?L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol?L-1NaOH溶液中水电离出来的c(OH-) |
| D、室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com