
����Ŀ����������Ԫ��(����Ԫ����ȥ)�����ڱ��е�λ������:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)E��G��T��ԭ�Ӱ뾶�ɴ�С��˳����_____(��Ԫ�ط���)��
(2)��Ԫ��(34Se)��Dͬ���壬��ǽ����Ա�D______(����ǿ����������)��
(3)E��GԪ������������Ӧˮ����֮���ܷ�Ӧ�����ӷ���ʽΪ:_______��
(4)E��D��Ԫ�����γ�ԭ�Ӹ�����1:1 �ͻ�����ĵ���ʽΪ________��
(5)A��M�γɵķ��ӿ�����________(����ĸ���)��

���𰸡�K��Na��Al �� Al(OH)3+OH-=![]() +2H2O
+2H2O ![]() ��
��
��������
����Ԫ����Ԫ�����ڱ��е�λ�ÿ�֪��AΪHԪ�أ�MΪCԪ�أ�BΪNԪ�أ�DΪOԪ�أ�EΪNaԪ�أ�GΪAlԪ�أ�RΪSԪ�أ�JΪClԪ�أ�TΪKԪ�أ��ݴ˽����ɷ������
(1)��������������֪��EΪNaԪ�أ�GΪAlԪ�أ�TΪKԪ�أ�ͬ����Ԫ�ش�������ԭ�Ӱ뾶���μ�С��ͬ����Ԫ�����϶���ԭ�Ӱ뾶���μ�С�����ԭ�Ӱ뾶��K��Na��Al��
(2)��Ԫ��(34Se)��Oͬ���壬λ��O���·���ͬ����Ԫ�����϶��·ǽ��������μ����������Ԫ��(34Se)�ķǽ����Ա�O����
(3)Na��AlԪ�ص�����������Ӧˮ����ֱ�ΪNaOH��Al(OH)3�����߷�Ӧ�����ӷ���ʽΪAl(OH)3+OH-=![]() +2H2O��
+2H2O��
(4)Na��O��Ԫ���γ�ԭ�Ӹ�����Ϊ1��1�͵Ļ�����ΪNa2O2��Na2O2�����ӻ����Na+��![]() �γ����Ӽ���
�γ����Ӽ���![]() ��Oԭ�Ӻ�Oԭ�Ӽ��γɹ��ۼ��������ʽΪ
��Oԭ�Ӻ�Oԭ�Ӽ��γɹ��ۼ��������ʽΪ![]() ��
��
(5)Cԭ���������4�����ӣ�����Hԭ���γ�4�Թ��õ��Ӷԣ���H��C���γɼ��飬��������ģ��Ϊ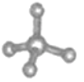 ���ʴ�ѡ�ۡ�
���ʴ�ѡ�ۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() mol
mol![]() ��������ˮ���100mL��Һ������Һ�м����������ʣ��йؽ�����ȷ����
��������ˮ���100mL��Һ������Һ�м����������ʣ��йؽ�����ȷ����
A.����50mL1![]() ����Ӧ������
����Ӧ������![]()
B.����![]() molCaO����Һ��
molCaO����Һ��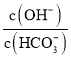 ��С
��С
C.����50mL![]() ����ˮ�������
����ˮ�������![]() ����
����
D.����![]() mol
mol![]() ���壬��Ӧ��ȫ����Һ������
���壬��Ӧ��ȫ����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԸ��������Һ�ķ�����ȷ���ǣ� ��
A.��������Һ���ܴ�����������ӣ�K����Na+��NO3-��CO32-
B.Ca(HCO3)2��Һ�����NaOH��Һ��Ӧ��HCO3-+Ca2��+OH-=CaCO3��+H2O
C.0.1molL��1Na2S��Һ�д��ڣ�c(OH-)=c(H+)+c(HS��)+2c(H2S)
D.NH4HSO4��Һ�����Ե���Ҫԭ���ǣ�NH4��+H2O![]() NH3H2O+H��
NH3H2O+H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ���ǣ� ��
A. �л���������ÿ��̼ԭ������γ�4�����ۼ�
B. ��ϩ��ʹ���Ը��������Һ����ˮ��ɫ�������߷�Ӧԭ������ͬ
C. ��Ũ��������£�����Ũ���Ṳ�������������ķ�Ӧ����ȡ����Ӧ
D. ��ϩ�ͱ����ܷ���������Ӧ��˵����ϩ�ͱ������о���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ A2+3B22C �ķ�Ӧ�����»�ѧ��Ӧ���ʵı�ʾ�У���Ӧ����������
A.��(A2) = 0.4 mol��L-1��s-1B.��(B2) = 0.8 mol��L-1��s-1
C.��(C) = 0.6 mol��L-1��s-1D.��(B2) = 4.2 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������͵����������DZ�����������Ҫ�ٴ롣
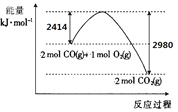
I����1����ҵ����������CO��ȼú����������
��֪S(s)��ȼ����(��H)Ϊ-mkJ/mol��CO��O2��Ӧ�������仯��ͼ��ʾ����CO��ȼú������������Ȼ�ѧ����ʽΪ______ (��H�ú�m�Ĵ���ʽ��ʾ) ��
��2����ģ��������ʵ���У���ij�����ܱ�������ͨ��2.8molCO��1molSO2���壬��Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
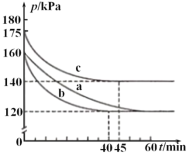
����ʵ��a��ȣ�ʵ��c�ı��ʵ������������_________��
��������������������������ʵ��b��ƽ�ⳣ��K=________�����г�����ʽ���ɣ���ע��ij���ʵ��������=�����ʵ����ʵ���/����������ʵ�����
��3��˫���ȥSO2��ԭ��Ϊ��NaOH��Һ![]() Na2SO3��Һ���÷����ܸ�Ч��ȥSO2�����ʯ�ࡣ
Na2SO3��Һ���÷����ܸ�Ч��ȥSO2�����ʯ�ࡣ
�ٸù�����NaOH��Һ��������_______��
��25��ʱ,��һ������SO2ͨ�뵽100mL0.1mol/L��NaOH��Һ�У�������ȫ��Ӧ�õ���Na2SO3��NaHSO3�Ļ����Һ����Һǡ�ó����ԣ�����Һ��H2SO3�����ʵ���Ũ����____�����跴Ӧǰ����Һ������䣻25��ʱ��H2SO3�ĵ��볣�� K1=1.0��10-2 K2=5.0��10-8)��
II����NH3����NO��Ⱦ�ķ�Ӧԭ��Ϊ��4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ��H= -1807.98kJ/mol ����ͬ�¶������£�NH3��NO�����ʵ���֮�ȷֱ�Ϊ4:1��3:1��1:3���õ�NO�ѳ���������ͼ��ʾ��
5N2(g)+6H2O(l) ��H= -1807.98kJ/mol ����ͬ�¶������£�NH3��NO�����ʵ���֮�ȷֱ�Ϊ4:1��3:1��1:3���õ�NO�ѳ���������ͼ��ʾ��
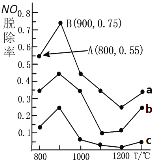
��1������a��NH3����ʼŨ��Ϊ4��10-5mol/L,��A�㵽B�㾭��1�룬��ʱ�����NO���ѳ�����Ϊ____mg/(L��s)��
��2�������Ժ��ֱ�����ϣ��¶ȳ���900�棬NO�ѳ�����Ȼ�½��������ڸ��������µ���������������Ӧ����NO�����ܵ�ԭ���У�һ�����ɣ�____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���Ӧ�����������![]()

A.ͼ�ױ�ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ���![]()
B.ͼ�ұ�ʾ![]() �ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����
�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����![]() ����
����
C.ͼ������![]() 0
0![]() ��Һ�ζ�
��Һ�ζ�![]() mL����ĵζ�����
mL����ĵζ�����
D.ͼ����ʾ��Ӧ![]() ƽ��ʱ
ƽ��ʱ![]() �����������ʼ
�����������ʼ![]() �仯�����ߣ���ת���ʣ�
�仯�����ߣ���ת���ʣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ����� ��
A. NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B. CuCl2![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. Al![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D. MgO(s)![]() Mg(NO3)2(aq)
Mg(NO3)2(aq)![]() Mg(s)
Mg(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ�����ʾNa2CO3��2Cl2===2NaCl��Cl2O��CO2�е��������������ȷ����(����)
A. Na���Ľṹʾ��ͼ��![]()
B. Cl2O�Ľṹʽ��Cl��O��Cl
C. ����������������3����ԭ�ӣ�3517Cl
D. CO2�ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com