
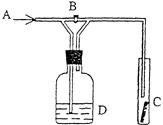
科目:高中化学 来源:不详 题型:单选题
| A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
| C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D.氯水经光照有气泡逸出,该气体为HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲=乙 | D.乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第一步通过浓硫酸,第二步通过无水氯化钙 |
| B.第一步通过碱石灰,第二步通过浓硫酸 |
| C.第一步通过饱和食盐水, 第二步通过无水氯化钙 |
| D.第一步通过水,第二步通过氧化钙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
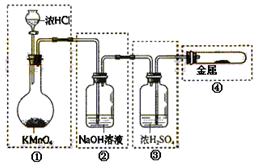
| A.只有①和②处 |
| B.只有②处 |
| C.只有②和③处 |
| D.只有②、③、④处 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 )溶液恰好完全吸收生成的碘单质,问100mL氯水中溶解了多少L标准状况下氯气?(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
)溶液恰好完全吸收生成的碘单质,问100mL氯水中溶解了多少L标准状况下氯气?(已知:2Na2S2O3+I2=Na2S4O6+2NaI)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。
5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。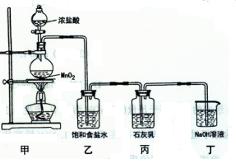
 的化学方程式是 , 乙装置的作用是 。
的化学方程式是 , 乙装置的作用是 。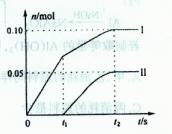
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置,进行实验。
5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置,进行实验。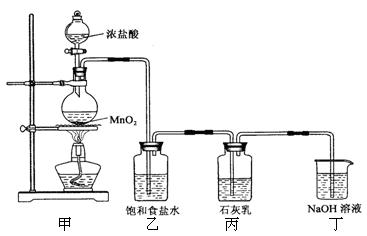
 制得Ca(ClO)2______________g。
制得Ca(ClO)2______________g。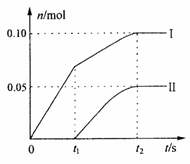
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com