
| ||
| ||
 ;
;

科目:高中化学 来源: 题型:
 硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )| A、电极X为电池负极 |
| B、OH-向电极X移动 |
| C、1mol VB2反应转移的电子数目是锂电池1mol Li反应转移的11倍 |
| D、VB2极的电极反应为2VB2+22e-+11H2O═2B2O3+V2O5+22OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
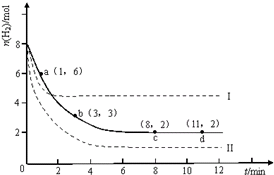 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、决定化学反应速率的主要因素是温度 |
| B、反应速率用于衡量化学反应进行快慢 |
| C、可逆反应达到平衡状态时正逆反应的速率都为0 |
| D、增大反应物的量或提高反应温度一定能增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com