
下列反应的离子方程式正确的是 ( )
A.NaAlO2溶液中通入过量的CO2:2AlO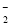 +3H2O+CO2===2Al(OH)3↓+CO
+3H2O+CO2===2Al(OH)3↓+CO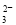
B.明矾溶液中滴加Ba(OH)2溶液至SO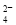 完全沉淀:Al3++Ba2++SO
完全沉淀:Al3++Ba2++SO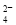 +3OH-===BaSO4↓+Al(OH)3↓
+3OH-===BaSO4↓+Al(OH)3↓
C.200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:
4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO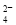 +3Cl-+H2O+4H+
+3Cl-+H2O+4H+
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
甲、乙两烧杯中各盛有 的盐酸和
的盐酸和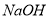 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
下列有关的计算分析不正确的是( )
A..在反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为 mol
mol
B.某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol
C.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧。则a、b的关系为 a=4b+3c
D.物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:填空题
(8分)海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图: (2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是: ;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.5 | 11.0 |
Cr(OH)3 | 4.3 | 5.0 |
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,
则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ;
③过滤后,为能得到纯净Mg Cl2晶体,采用的操作方法是: ;
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
室温下,在0.2mol/LAl2(SO4)3,溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
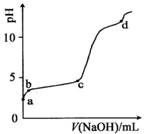
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH- Al(OH)3
Al(OH)3
B.d点时,Al(OH)3沉淀开始溶解
C.a-b段,溶液pH增大,A13+浓度不变
D.b-c段,加入的OH-主要用于生成AI(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,请你判断下列叙述中正确的是
A.2NA个HF分子所占的体积约为44.8L
B.46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA
C.常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA
D.5.6 g铁与500 mL 2 mol · L-1硝酸反应,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:填空题
(8分)已知:常温常压下,D、E、F、I、J为气体; 1molE与含1molF的水溶液恰好反应生成B。B是一种常见的化肥。物质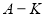 之间有如下图所示转化关系(部分反应中生成的水已略去)。
之间有如下图所示转化关系(部分反应中生成的水已略去)。
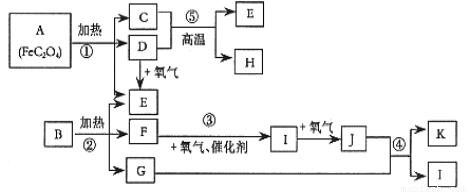
试回答下列问题:
(1)已知A中 和C中Fe元素均为+2价,则
和C中Fe元素均为+2价,则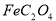 中碳元素的化合价为______
中碳元素的化合价为______
(2)B的化学式为___________________。
(3)写出反应③的化学方程式 _______________________ _____。
(4)写出过量单质H与K的稀溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(13分)铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com