
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
分析 A.根据v=$\frac{△c}{△t}$计算v(O2),再利用速率之比等于其化学计量数之比计算v(NO2);
B.由表中数据可知,12s与24s时氧气的物质的量均为0.8mol,说明12s时可逆反应到达平衡,平衡时氧气的浓度为$\frac{0.8mol}{2L}$=0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动;
C.容器体积不变,在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,转化到左边相当于起始投入2.0molNO2和1.0molO3,与原平衡为完全等效平衡,平衡时压强相等,即平衡时混合气体总物质的量相等,结合表中数据计算平衡时混合气体总物质的量,再利用压强之比等于物质的量之比计算;
D.在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,转化到左边相当于起始投入4.0molNO2和2.0molO3,所到达的平衡状态相当于在原平衡的基础上压强增大一倍,平衡先正反应方向移动,平衡时N2O5的物质的量大于2×0.8mol=1.6mol,故参加反应的N2O5的物质的量小于2mol-1.6mol=0.4mol,据此计算判断.
解答 解:A.由表中数据可知,3s内压强物质的量变化量为0.36mol,容器体积为2L,故0~3s内v(O2)=$\frac{\frac{0.36mol}{2L}}{3s}$=0.06mol/(L.s),速率之比等于其化学计量数之比,故v(NO2)=2v(O2)=2×0.06mol/(L.s)=0.12mol/(L.s),故A错误;
B.由表中数据可知,12s与24s时氧气的物质的量均为0.8mol,说明12s时可逆反应到达平衡,平衡时氧气的浓度为$\frac{0.8mol}{2L}$=0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,即△H<0,故B正确;
C.容器体积不变,在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,转化到左边相当于起始投入2.0molNO2和1.0molO3,与原平衡为完全等效平衡,平衡时压强相等,12s到达平衡时氧气的物质的量为0.8mol,则:
2NO2(g)+O3(g)?N2O5(g)+O2(g) 物质的量减少
1 1
0.8mol 0.8mol
故原平衡中平衡时气体物质的量为2mol+1mol-0.8mol=2.2mol,即起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2到达平衡时,混合气体总物质的量为2.2mol,平衡时压强为起始的$\frac{2.2mol}{(1+0.5+0.5+0.5)mol}$=0.88倍,故C正确;
D.在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,转化到左边相当于起始投入4.0molNO2和2.0molO3,所到达的平衡状态相当于在原平衡的基础上压强增大一倍,平衡先正反应方向移动,平衡时N2O5的物质的量大于2×0.8mol=1.6mol,故参加反应的N2O5的物质的量小于2mol-1.6mol=0.4mol,则达到平衡时,N2O5的转化率小于$\frac{0.4mol}{2mol}$×100%=20%,故D错误,
故选BC.
点评 本题考查化学平衡有关计算及影响因素、反应速率有关计算等,侧重考查等效平衡,C、D选项中关键是构建等效平衡途径,若利用平衡常数计算相对比较麻烦,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
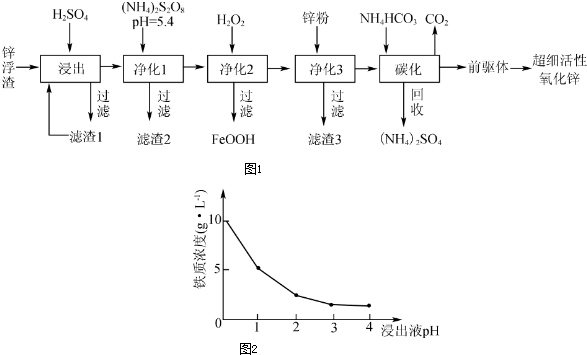
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
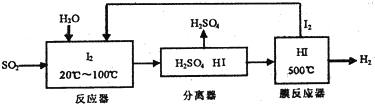
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
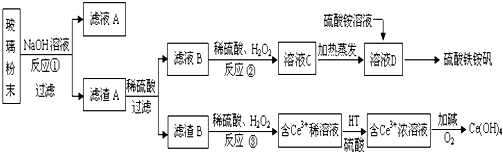
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
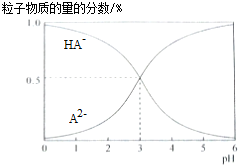
| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
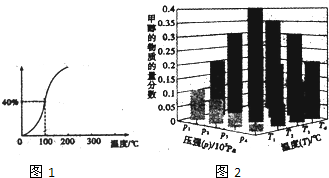
 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )| A. | a容器中,0~5min反应速率v(H2)=0.08mol•L-1•min-1 | |
| B. | 反应进行到5min时,b容器中v正=v速 | |
| C. | 其他条件不变时,减压可将b中的状态转变成c中的状态 | |
| D. | 达到平衡时a、b、c容器中的转化率为b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 芳香烃的分子通式是CnH2n-6 (n≥6) | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 苯和甲苯都不能使KMnO4酸性溶液褪色 | |
| D. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全由非金属组成的化合物不一定是共价化合物 | |
| B. | 构成分子晶体的粒子一定含有共价键 | |
| C. | 分子晶体的熔点一定比金属晶体的熔点低 | |
| D. | 含有金属离子的晶体一定是离子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com