
分析 (1)被还原的硝酸生成NO、NO2,根据N元素守恒计算被还原硝酸的物质的量;
(2)令混合物中Cu、Ag物质的量分别为xmol、ymol,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算Ag的质量;
(3)令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒列方程计算,进而计算一氧化氮和二氧化氮的体积.
解答 解:(1)收集到的气体为NO2和NO,故被还原的n(HNO3)=n(NO2+NO)=6.72 L÷22.4L•mol-1=0.30mol,
答:被还原的硝酸的物质的量为0.3mol;
(2)反应的n(HNO3)=13.5 mol•L-1×0.08L-1.0 mol•L-1×0.08L=1 mol
设合金中铜、银物质的量分别为xmol、ymol,则:
64x+108y=30 ①
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x mol、y mol,据N守恒可得:
2x+y+0.3=1 ②
联立①②,解得x=0.3 y=0.10 mol
故合金中银的质量=0.10 mol×108g/mol=10.8g,合金中银的质量分数为:$\frac{10.8g}{30g}×100%$=36%,答:合金中银的质量分数为36%;
(3)令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒,则:
$\left\{\begin{array}{l}{a+b=\frac{6.72}{22.4}}\\{3a+b=0.3×2+0.1×1}\end{array}\right.$
解得a=0.2,b=0.1
故混合气体中NO2的体积=0.1mol×22.4L/mol=2.24L,V(NO)=4.48L,
答:NO和NO2体积分别是:4.48L和2.24L.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意守恒思想的应用.


科目:高中化学 来源: 题型:解答题
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
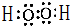
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
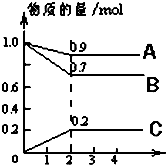 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H50 | B. | C30H56 | C. | C36H72 | D. | C30H60 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
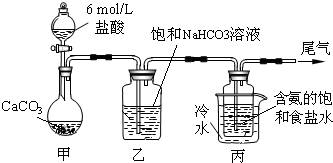
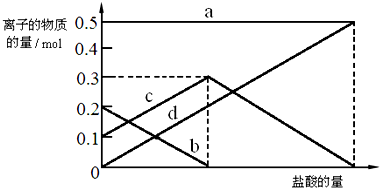
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com