
| A、原子半径:S>Mg>H |
| B、元素金属性:Na>K>Al |
| C、热稳定性:HCl>H2S>PH3 |
| D、酸性:H2SO4>HClO4>H2CO3 |


科目:高中化学 来源: 题型:

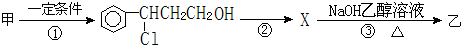
 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Fe3+、Na+、NO3- |
| B、Fe3+、NH4+、SCN-、Cl- |
| C、H+、I-、Na+、SiO32- |
| D、NH4+、OH-、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制O2完毕后,应先从水槽中撤出导气管,再停止加热 |
| B、洗涤沉淀时,将蒸馏水浸没沉淀再进行过滤,重复多次即可洗净 |
| C、萃取操作可以在试管中进行,分液操作必须在分液漏斗中进行 |
| D、称量NaOH固体时,应将砝码放在托盘天平右盘纸片上,NaOH固体放在左盘的纸片上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的Cu与含硫酸2mol的浓硫酸反应产生NA个SO2分子 |
| B、1mol O2在反应中作氧化剂时所得电子数一定为4NA个 |
| C、1molHCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数均为NA个 |
| D、常温下,1L 1mol/L Na2CO3溶液中所含的碳原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入明矾,使海水的盐分沉淀并淡化 |
| B、海水蒸发制海盐的过程中只发生了物理变化 |
| C、海水淡化的方法主要有蒸馏法、离子交换法和电渗透法等 |
| D、大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜溶液与硫酸的反应OH-+H+=H2O |
| B、澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中Cu+2Ag+=Cu2++2Ag |
| D、碳酸钙溶于稀盐酸中CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com