
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
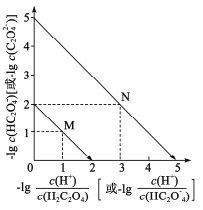
A.曲线M表示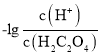 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.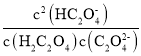 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
【答案】BC
【解析】
二元弱酸的电离常数Ka1>Ka2,斜线M表示表示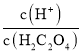 和
和![]() 的乘积等于10-2,
的乘积等于10-2,
斜线N表示表示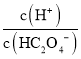 和
和![]() 的乘积等于10-5。
的乘积等于10-5。
A.H2C2O4为二元弱酸,第一步电离平衡常数大于第二部电离平衡常数,故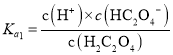 大于
大于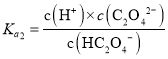 ,即
,即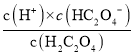 >
>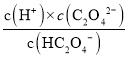 ,则
,则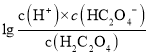 >
>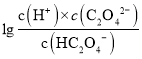 ,即
,即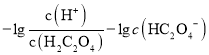 <
<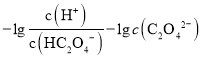 ,因此曲线M表示
,因此曲线M表示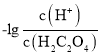 和
和![]() 的关系,A正确;
的关系,A正确;
B.当pH=5时,溶液呈酸性,c(OH-)<c(H+),c(H+)=10-5mol/L,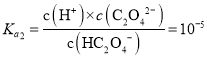 ,则c(HC2O
,则c(HC2O![]() )=c(C2O
)=c(C2O![]() ),根据电荷守恒c(Na+)+c(H+)=c(HC2O
),根据电荷守恒c(Na+)+c(H+)=c(HC2O![]() )+2c(C2O
)+2c(C2O![]() )+c(OH-),则c(Na+)-3c(HC2O
)+c(OH-),则c(Na+)-3c(HC2O![]() )=c(OH-)-c(H+)<0,B错误;
)=c(OH-)-c(H+)<0,B错误;
C.已知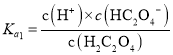 ,
,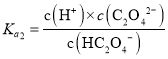 ,
, ,则
,则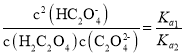 ,与溶液的pH无关,C错误;
,与溶液的pH无关,C错误;
D.由上图可知,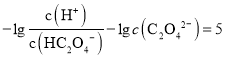 ,则
,则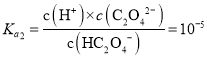 ,同理Ka1=10-2,则草酸氢钠的水解平衡常数=Kw/Ka1=10-12,小于Ka1,说明以电离为主,溶液显酸性,则中c(Na+)>(HC2O
,同理Ka1=10-2,则草酸氢钠的水解平衡常数=Kw/Ka1=10-12,小于Ka1,说明以电离为主,溶液显酸性,则中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4),D正确;
)>c(H2C2O4),D正确;
故选BC。


科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1mol B和1mol CB.2mol A、3mol B和1mol He(He不参加反应)
C.2mol CD.2mol A、3mol B和3mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
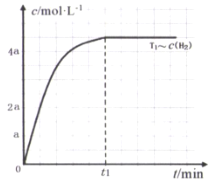
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
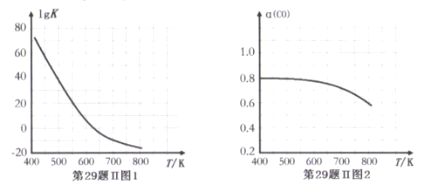
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
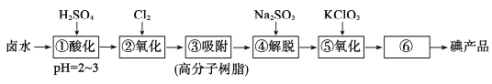
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO![]() +H2O=4I-+SO
+H2O=4I-+SO![]() +2H+
+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图实验。
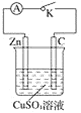
(1)打开K,观察到的现象为________________。
(2)关闭K,观察到的现象是_________。此电池的负极的电极反应式为_____。
(3)关闭K,溶液中阳离子向_______(填“Zn”或“C”)极移动,外电路中,电子流动方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,e常作为半导体材料。下列说法错误的是( )

A.d的硫酸盐溶液呈酸性
B.a元素与b元素可形成核外电子总数为8的分子
C.图2为上述六种元素中的一种元素形成的含氧酸的结构
D.e单质能与c的最高价氧化物对应水化物的溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com